化学 ☝️🤓元素化学(好吃☢️
本帖是关于元素化学的拓展睡前故事(需要上完预备轮才建议观看)
胆小、嗜睡者慎入!!PS:本帖在观看时可以呼吸
本系列相较于$ZnTellurium$的元素笔记更全面,更完善,但是本系列知识深度较低,适合作为睡前阅读
如果有错误,请立即指出,不胜感激!
每一次对错误的指正,都是对科学最大的尊重(取自某一个科普读物的扉页)
----------------------------------------------
镇帖:同位素表 - https://people.physics.anu.edu.au/~ecs103/chart/👈这玩意第一次加载需要很长时间,建议用电脑
本帖ID:64997
超链接:猫猫虫元素化学第一期:Sr锶
----------------------------------------------
猫猫虫元素化学-第1期-锶$Sr$
Upgrade Data-最新更新:02/20/2026 22:41
发帖时间:$02/19/2026$
增修时间:$02/20/2026$(修改了1.3.2.4、1.3.3.12、部分$LaTeX$;增加了目录检索、1.1.3、1.4、1.5部分)
----------------------------------------------
目录检索 -CONTENTS
1-锶Sr
1.1 总述
1.1.1 总述的总述
1.1.2 主要用途
1.1.3 发现及命名
1.2 物理性质
1.3 化学性质
1.3.1 单质的制备
1.3.2 氧化物
1.3.2.1 氧化锶
1.3.2.2 过氧化锶
1.3.2.3 超氧化锶
1.3.2.4 臭氧化锶
1.3.3 锶盐
1.3.3.1 氟化锶
1.3.3.2 氯化锶
1.3.3.3 溴化锶
1.3.3.4 碘化锶
1.3.3.5 碳酸锶
1.3.3.6 硫酸锶
1.3.3.7 亚硫酸锶
1.3.3.8 硝酸锶
1.3.3.9 亚硝酸锶
1.3.3.10 草酸锶
1.3.3.11 乙酸锶
1.3.3.12 碳化锶
1.3.3.13 硫化锶
1.3.3.14 磷化锶
1.4 锶的矿物
1.4.1 天青石
1.4.1.1 物理性质
1.4.1.2 产地
1.4.1.3 自然成因
1.4.2 菱锶矿
1.4.2.1 物理性质
1.4.2.2 产地
1.4.2.3 自然成因
1.5 同位素
1.5.1 $^{88}_{38}Sr$(锶88)
1.5.2 $^{90}_{38}Sr$(锶90)
1.5.3 同位素危害防治
1.6 锶与生物体
1.7 锶与生活/世界
1.8 总结
1.9 参考资料/文献的整理
----------------------------------------------
1.1 元素Sr的总述
1.1.1 总述的总述
锶,英文名称为$Strontium$,元素符号Sr,是一种银灰色带有黄色光泽的碱土金属,化学性质非常活泼。锶的相对原子质量为87.62,一般取88。

上方是金属态的纯锶
锶的核外电子排布为$[Kr]5s^2$,因此,Sr通常会显示0或+2价。在地壳中,Sr的丰度(按照质量$Clarke$值计算)排在第$22$位,为$0.015$%
锶在元素周期表中在第五周期,第二族,和$Ca,Ba,Be$的性质相似,和$Ca$尤其相似。
锶的还原性很强,在某些时候可以代替$Mg,Ca$等金属还原一些金属氯化物得到相应金属
1.1.2 主要用途
没啥好说的,首先看$SrSO_4$,硫酸锶的对应矿物叫做天青石,正常情况下,硫酸锶是白色或透明色,但是天青石通常是蓝色,这个会在1.4中详细介绍。硫酸锶会在医院中和石膏(二水合硫酸钙)混合使用。一般硫酸锶的含量较少。
$SrTiO_3$钛酸锶和钛酸钡经常以1:1的比例混合作为电容器(包括铝电解电容器)的添加剂。这种电容一般抗压性更高,容量也更高,可以大大缩小电容的体积。一个和食指大小相当的铝电解电容器的电容值在$0.8F~2F$之间(法拉是一个很大很大的单位)
锶的简单无机盐(例如氯化锶,硫酸锶)可以作为炼钢时的脱硫剂,甚至可以脱磷。
锶的现代用途为:作为磁性材料的添加剂;作为显像管,显示器,工业监视器,制造$Sr-Fe-O$载体等
1.1.3 发现及命名
锶的发现可以追溯到18世纪末。1790年,英国化学家威廉首次从天青石中分离出一种新元素,并将其命名为“$strontia$”,后来该元素被正式命名为锶。直到1808年,戴维通过电解熔融的锶盐成功制得纯金属锶,从而确认了它的存在。
1.2 物理性质
锶的比重是$2.63$,莫氏硬度约为$1.8$,熔点$768$摄氏度($1041K$),沸点$1381$摄氏度($1654K$),原子半径为$191.4pm$,$Sr^{2+}$半径为$113pm$,标准电势为$-2.89V$。
1.3 化学性质
1.3.1 单质的制备
由于锶是活泼金属,所以只能用以下两种方式制备
第一种:
使用电解槽:$SrCl_2(l)=电解=Sr+Cl_2$
第二种:
使用还原剂:$Ca+SrCl_2(l)===Sr+CaCl_2$
1.3.2 氧化物
锶有很多种氧化物,包括普通的氧化锶$SrO$,过氧化锶$SrO_2$,超氧化锶$Sr(O_2)_2$,臭氧化锶$Sr(O_3)_2$。
1.3.2.1 氧化锶
首先,得到氧化锶的方法有:
锶在空气中自己氧化或加热氧化:
$2Sr+O_2=2SrO$
或者是碳酸锶的高温锻烧:
$SrCO_3===SrO+CO_2$
和氧化钙类似,氧化锶溶于水也剧烈反应放热生成氢氧化锶:
$SrO+H_2O===Sr(OH)_2$
同样的,氢氧化锶的溶液度虽然比氢氧化钙大一些,但比氢氧化钡小,氢氧化锶同样也是显强碱性。
1.3.2.2 过氧化锶
过氧化锶得到的方式比较复杂,最常见的方法是氧化锶和200+个标准大气压下的氧气反应,并共热生成过氧化锶。
$2SrO+O_2===2SrO_2$
过氧化锶遇水放出氧气,还会生成一些八水合过氧化锶。
$2SrO_2+2H_2O===2Sr(OH)_2+O_2$
八水合过氧化锶在约200摄氏度(470K)加热下分解为过氧化锶和水蒸气,条件不好过氧化锶会分解生成氧化锶和氧气。
1.3.2.3 超氧化锶
超氧化锶需要用到过氧化锶的过氧化氢合物($SrO_2-nH_2O_2$),这些物质需要在真空下加强热才会生成少量的超氧化锶。
$SrO_2+2H_2O_2===Sr(O_2)_2+2H_2O$
超氧化锶不如超氧化钡稳定。超氧化锶一旦遇到水蒸气都会剧烈分解。
$2Sr(O_2)_2+2H_2O===2Sr(OH)_2+3O_2$
1.3.2.4 臭氧化锶
《普通无机化学》上有记载,水解方程式:
$2Sr(O_3)_2+2H_2O=2Sr(OH)_2+5O_2$
这种物质很不稳定,在潮湿的空气中剧烈分解,甚至微微加热就能爆炸
P.S. 其实Ca,Sr,Ba,Ra都能形成臭氧化物(Be,Mg不行!),$Ca(O_3)_2$最不稳定。相反,$Ra(O_3)_2$较稳定
1.3.3锶盐
1.3.3.1. 氟化锶(SrF₂)
氟化锶是一种白色结晶固体,难溶于水(Ksp ≈ 2.5 × 10⁻⁹),在水中几乎不电离。其化学性质稳定,具有较高的热稳定性,熔点约为 $1470°C$,常用于制备光学材料和激光晶体。由于 F⁻ 离子半径小且电荷密度高,$SrF₂$中的离子键较强,使其不易被酸或碱破坏。在强酸中,如浓 H₂SO₄ 或 HF,可缓慢反应生成氢氟酸和硫酸锶:
$SrF_2 + H_2SO_4 ===SrSO_4 + 2HF$
在高温下,氟化锶可与金属氧化物发生反应,生成相应的氟化物,例如与 Al₂O₃ 反应生成 AlF₃ 和 SrO。此外,SrF₂ 在电弧灯和荧光粉中用作掺杂剂,因其能发射特定波长的光。它在自然界中以矿物“氟锶矿”形式存在。氟化锶对生物体有毒性,尤其在摄入后可能影响骨骼系统,因此需谨慎使用。
1.3.3.2. 氯化锶(SrCl₂)
氯化锶是白色结晶固体,易溶于水,溶解度随温度升高而显著增加。其水溶液呈中性,因 Sr²⁺ 和 Cl⁻ 均不发生明显水解。氯化锶在空气中吸湿性强,易潮解,通常以六水合物($SrCl₂·6H₂O$)形式存在。加热时,六水合物逐渐失去结晶水,最终得到无水氯化锶。无水氯化锶在高温下稳定,但遇水会剧烈水合并放热。在电解条件下,其水溶液阴极析出氢气,阳极产生氯气,而非金属锶,因为Sr²⁺的还原电位较低。氯化锶常用于制造其他锶盐,如硝酸锶、碳酸锶等。在火焰试验中,Sr²⁺ 产生鲜红色焰色,广泛应用于烟花和信号弹。此外,氯化锶在有机合成中可用作催化剂,促进某些偶联反应。其毒性较低,但仍需避免长期接触。
1.3.3.3. 溴化锶(SrBr₂)
溴化锶为白色或无色晶体,易溶于水,水溶液呈中性。其溶解度较高,约 $102 g/100 mL(20°C)$。在水溶液中,Sr²⁺ 和 Br⁻ 完全电离,形成强电解质。溴化锶在空气中稳定,但长时间暴露可能因吸收水分而潮解。加热至高温时,溴化锶融化,如果电解,发生如下反应:
$SrBr_2===Sr+Br_2$
电解其水溶液阴极产生氢气,阳极产生溴单质,同时生成氢氧化锶:
$2SrBr_2+2H_2O===2Sr(OH)_2+Br_2+H_2$
这表明 Br⁻ 比 OH⁻ 更容易被氧化。溴化锶可用于制备其他锶化合物,如碳酸锶或草酸锶。在$he$工业中,SrBr₂ 可作为同位素载体。其水溶液在光照下可能缓慢分解,释放少量 Br₂。由于 Br⁻ 具有还原性,溴化锶在强氧化剂存在下可能发生氧化反应。该化合物在实验室中常用作锶源。
1.3.3.4. 碘化锶(SrI₂)
碘化锶为白色或淡黄色晶体,易溶于水,溶解度约为 80 g/100 mL(20°C),但具有较强的吸湿性,需密封保存。其水溶液呈中性,但 I⁻ 离子具有较强的还原性,在空气中或光照下易被氧化成碘单质,使溶液变黄甚至棕红:
$2I^- + O_2 + 4H^+ ===I_2 + 2H_2O$
在酸性条件下,I⁻ 易被氧化剂(如 HNO₃、H₂O₂)氧化为 I₂。与银盐反应生成黄色 AgI 沉淀,可用于定性分析。碘化锶在医学中用作¹³¹I的载体,用于甲状腺疾病的诊断和治疗。此外,它在红外光学材料和半导体掺杂中也有应用。由于 I⁻ 的还原性和挥发性,碘化锶在储存和使用过程中需避免与氧化剂接触。
1.3.3.5. 碳酸锶(SrCO₃)
碳酸锶为白色粉末,难溶于水(Ksp ≈ 5.6 × 10⁻¹⁰),但可溶于稀酸,如盐酸或硝酸,释放二氧化碳气体:
$SrCO_3 + 2HCl ===SrCl_2 + CO_2 + H_2O$
Ta是其最典型的化学性质,常用于鉴定锶离子的存在。在高温下(约 1200°C),碳酸锶分解为氧化锶和二氧化碳:
$SrCO_3===SrO + CO_2$
该反应可用于制备高纯度氧化锶。碳酸锶在空气中稳定,不与氧气或氮气反应。它与碱土金属离子(如 Ca²⁺、Ba²⁺)的碳酸盐类似,属于弱碱性盐。在工业上,碳酸锶用于生产电子陶瓷、荧光粉、玻璃和搪瓷。在分析化学中,它作为沉淀剂用于分离锶离子。由于其低溶解度,碳酸锶常用于沉淀法提纯锶。其热稳定性高于碳酸钙,但低于碳酸钡。
1.3.3.6. 硫酸锶(SrSO₄)
硫酸锶为白色结晶固体,难溶于水(Ksp ≈ 3.2 × 10⁻⁷),但可溶于浓硫酸或热浓盐酸。其化学性质稳定,在空气中不分解,也不与氧气或氮气反应。在高温下(>1000°C)可部分分解为氧化锶和三氧化硫:
$2SrSO_4===2SrO+2SO_2+O_2$
在强酸中,SrSO₄ 不溶解。
与碳酸钠反应可生成碳酸锶沉淀,用于置换反应:
$SrSO_4+Na_2CO_3===SrCO_3+Na_2SO_4$
此反应用于提纯锶盐。硫酸锶在医学上曾用作X射线造影剂,因其对X射线吸收能力强。在工业上,它是制造其他锶盐的重要中间体。由于其低溶解度,常用于沉淀法分离锶离子。硫酸锶对环境友好,毒性较低,但长期接触可能引起皮肤刺激。
1.3.3.7. 亚硫酸锶(SrSO₃)
亚硫酸锶为白色粉末,微溶于水,但在水中不稳定,易被空气中的氧气氧化为硫酸锶:
$2SrSO_3+O_2===2SrSO_4$
因此,其水溶液通常呈弱碱性,因 SO₃²⁻ 水解生成 HS⁻ 和 OH⁻。在酸性条件下,亚硫酸锶迅速分解,释放二氧化硫气体:
$SrSO_3+2HCl===SrCl_2+SO_2+H_2O$
该反应可用于检测亚硫酸根离子。加热时,亚硫酸锶分解为氧化锶和二氧化硫:
$SrSO_3===SrO+SO_2$
亚硫酸锶用于制备其他含硫锶化合物,或作为还原剂。由于其强还原性,需避免与氧化剂共存。它在自然界中罕见,主要通过化学合成制得。亚硫酸锶在纺织和漂白工业中有潜在应用,但因稳定性差,使用受限。
1.3.3.8. 硝酸锶(Sr(NO₃)₂)
硝酸锶为白色结晶固体,易溶于水,水溶液呈中性。其化学性质活泼,是强氧化剂。在加热时,硝酸锶分解为氧化锶、二氧化氮和氧气:
$2Sr(NO_3)_2 === 2SrO + 4NO_2 + O_2 $
该反应在燃烧或爆炸中常见。在火焰中,Sr²⁺ 发出鲜红色光,广泛用于烟花和信号弹。硝酸锶与碱反应生成氢氧化锶沉淀:
$Sr(NO_3)_2 + 2NaOH === Sr(OH)_2+ 2NaNO_3$
与碳酸盐或草酸盐反应生成相应沉淀。在电解条件下,阴极析出氢气,阳极产生氧气。硝酸锶在农业中可用作微量元素肥料,在电子工业中用于制备氧化锶薄膜。由于其氧化性,需远离还原性物质储存。其水溶液稳定,但受热易分解。
1.3.3.9. 亚硝酸锶(Sr(NO₂)₂)
亚硝酸锶为白色或淡黄色晶体,易溶于水,水溶液呈弱碱性,因 NO₂⁻ 水解生成 HNO₂ 和 OH⁻。其化学性质以还原性为主,在酸性条件下易被氧化为硝酸盐,同时释放一氧化氮:
$Sr(NO_2)_2+2HNO_3===Sr(NO_3)_2+NO+NO_2+H_2O$
加热时分解为氧化锶、一氧化氮和氧气:
$2Sr(NO_2)_2===2SrO + 4NO+O_2$
在空气中不稳定,易被氧化。与碱金属氧化物反应生成硝酸盐。亚硝酸锶在工业上用于制备硝酸锶或作为还原剂。在食品工业中,曾用作防腐剂(类似亚硝酸钠),但因毒性较高,现已被限制使用。其水溶液在光照下颜色加深,表明氧化正在进行。需避光、密封保存。
1.3.3.10. 草酸锶(SrC₂O₄)
草酸锶为白色结晶粉末,极难溶于水(Ksp ≈ 1.6 × 10⁻⁷),但可溶于强酸,如 HCl 或 H₂SO₄,释放草酸:
$SrC_2O_4+2HCl ===SrCl_2+H_2C_2O_4$
在分析化学中,草酸锶常用于锶的定量分析和沉淀分离。加热时分解为氧化锶、一氧化碳和二氧化碳:
$SrC_2O_4===SrO+CO+CO_2 $
该反应可用于制备高纯度氧化锶。草酸锶在空气中稳定,不与氧气反应。在有机合成中,可用作锶源或催化剂前驱体。由于其低溶解度,常用于重量分析法测定锶含量。其沉淀过程选择性高,不受大多数阳离子干扰。
1.3.3.11. 乙酸锶(Sr(CH₃COO)₂)
乙酸锶为白色晶体,易溶于水,微溶于乙醇。其水溶液呈弱碱性,因 CH₃COO⁻ 水解生成 OH⁻ 和 CH₃COOH。加热时分解为氧化锶、乙酸和乙酸酐.
在碱性条件下,与碱反应生成氢氧化锶沉淀:
$Sr(CH_3COO)_2 + 2NaOH === Sr(OH)_2 + 2CH_3COONa$
在有机合成中,乙酸锶可用作催化剂,促进酯交换、缩合等反应。它在医药工业中用于制备锶盐药物。乙酸锶在空气中稳定,但易吸湿。其水溶液可与钙、镁等离子发生复分解反应,生成相应沉淀。由于其良好的溶解性和催化活性,广泛用于科研和工业。
1.3.3.12. 碳化锶(SrC₂)
碳化锶为黑色固体,由氧化锶锶与碳在约2500K下反应制得。
$SrO+3C===SrC_2+CO$
其化学性质活泼,遇水剧烈反应,生成乙炔(C₂H₂)和氢氧化锶:
$SrC_2 + 2H_2O===Sr(OH)_2 + C_2H_2$
该反应类似于碳化钙(CaC₂),是乙炔的制备方法之一。
另一种生产氰氨化锶(一种化肥)的方法:
$SrC_2+N_2===SrCN_2+C$
氰氨化锶水解会释放出剧毒的氰胺($H_2N-CN$),需要小心使用。
$SrCN_2+2H_2O===Sr(OH)_2+H_2NCN$
碳化锶在空气中自燃,需隔绝空气储存。碳化锶在高温下稳定,但遇酸迅速分解,释放乙炔气体。其结构中含有 C≡C⁻ 离子,具有强还原性。在工业上,主要用于实验室制备乙炔。由于其高反应活性和危险性,使用时需严格防护。
1.3.3.13. 硫化锶(SrS)
硫化锶为白色或灰白色固体,易溶于水,水溶液呈强碱性,因 S²⁻ 水解生成 HS⁻ 和 OH⁻。在空气中不稳定,易被氧化为硫酸锶。与酸反应生成硫化氢气体:
$SrS + 2HCl === SrCl_2 + H_2S $
该气体有臭鸡蛋味,有毒。在点燃时的反应:
$2SrS +3O_2=2SrO+2SO_2$
在工业上,硫化锶用于制备荧光粉、发光材料和半导体。在冶金中用作脱氧剂。由于其强碱性和还原性,需避免与酸和氧化剂接触。硫化锶在自然界中罕见,主要通过化学合成获得。
1.3.3.14. 磷化锶(Sr₃P₂)
磷化锶为灰色或黑色固体,由锶与磷在高温下反应制得。其化学性质活泼,遇水剧烈反应,生成磷化氢(PH₃)和氢氧化锶:
$Sr_3P_2 + 6H_2O ===3Sr(OH)_2 + 2PH_3 $
PH₃ 是剧毒气体,具有大蒜味。在空气中自燃,需隔绝空气储存。与酸反应也生成 PH₃。磷化锶在工业上用于制备磷化物半导体或作为磷源。由于其高反应活性和毒性,使用时需严格防护。在实验室中,主要用于研究磷化物的化学行为。
1.4 关于锶的矿物
1.4.1天青石
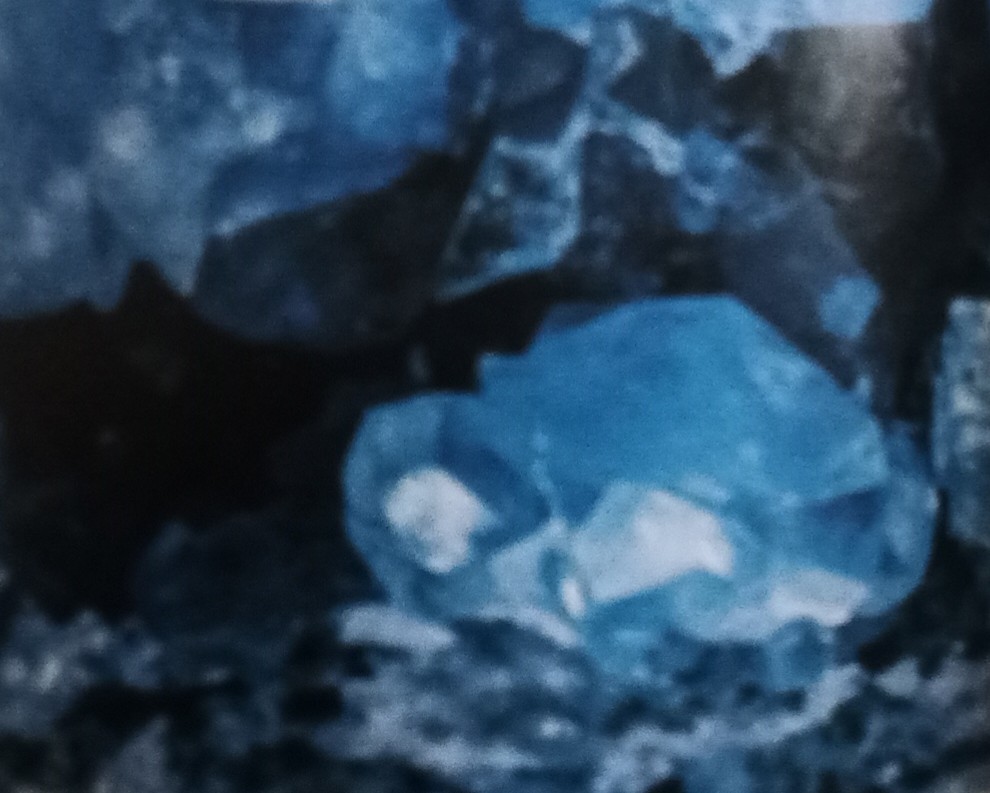
上方是天青石的图片
如你所见,天青石是一种蓝色矿石,属于一种硫酸盐矿物,是自然界中最主要的含锶矿物。完好的晶体较为少见,集合体较多呈现致密块状、钟乳状,纤维状,细粒状,结合状。天青石可以和重晶石形成完全类质同象系列,而富含Ba的被称为钡天青石。
1.4.1.1 物理性质
-->成分:$SrSO_4$
-->硬度:3~3.5
-->比重:3.97
-->解理:完全
-->断口:参差状至多片状
-->晶系:斜方晶系
-->溶解度:不溶于酸,微溶于水
灼烧时火焰成深紫红色,在紫外线照射下发出荧光。
1.4.1.2 产地
-->主要产区:江苏潥水
-->其他产区:内蒙古、东北三省、陕甘一带、重庆、湖南湖北
1.4.1.3 自然成因
主要在热液矿床、沉积矿床、沉积岩(例如大理石,泥灰石,白云石)中形成,通常与石膏($CaSO_4-2H_2O$),重晶石($BaSO_4$)和白云石($MgCa(CO_3)_2$)共生。
1.4.2 菱锶矿(也叫做碳酸锶矿)

菱锶矿的图片
如你所见,这是一种白色不透明的矿石,菱锶矿是文石族矿物之一,晶体在自然界中较为少见,通常是针状或柱状,集合体呈粒状,柱状,放射状等。它的变种有钡碳酸锶和钙碳酸锶。
1.4.2.1 物理性质
-->成分:$SrCO_3$
-->硬度:4
-->比重:3.7~3.8
-->解理:中等或不完全
-->断口:参差状
-->晶系:斜方晶系
-->溶解度:溶于各种酸,不溶于水
在阴极射线照射下,发出浅蓝光。
1.4.2.2 产地
全国各地均有少量产出。
1.4.2.3 自然成因
主要在中低温热液成因下形成,多产于石灰石,凝灰石中,常和$BaCO_3、CaCO_3、BaSO_4、SrSO_4、CaSO_4、CaF_2、SrF_2$共生。
1.5 同位素
锶有常见的两种同位素,分别是$^{88}_{38}Sr$和$^{90}_{38}Sr$,其中$^{88}_{38}Sr$稳定,$^{90}_{38}Sr$具有放射性。
1.5.1 $^{88}_{38}Sr$ 锶88
锶-88(⁸⁸Sr)是锶元素的一种稳定同位素,占自然界中锶的约82.6%。
它无放射性,广泛存在于地壳中,常用于地质学和地球化学研究中的同位素示踪。
由于其化学性质与钙相似,锶-88在生物体内可被骨骼吸收,但不会对健康造成危害。
1.5.2 $^{90}_{38}Sr$ 锶90
锶-90(⁹⁰Sr)是一种具有放射性的同位素,半衰期约为28.81年,属于β衰变核素。
它是核裂变的重要产物之一,常见于核武器爆炸和核电站事故释放的放射性尘埃中。
锶-90因化学性质与钙相近,易被人体吸收并沉积在骨骼中,长期暴露可能导致骨癌、白血病等严重健康问题,因此被列为高风险放射性污染物。
锶90衰变方程式:
$^{90}_{38}Sr===^{90}_{39}Y+β^-+ν_e$ $t_{1/2}=28.81y$
(这个是$β^-$衰变喵)
1.5.3 锶同位素危害防治
在锶同位素危害防治方面,应重点关注放射性锶-90的控制。
加强核设施的安全管理其次,在核事故后及时开展环境监测,采取土壤固化、植物修复等措施减少锶的迁移。
避免食用受污染的水源和食物,必要时进行医学筛查。
发展高效的锶吸附材料和技术,如使用离子交换树脂或纳米材料,有助于从环境中去除锶-90。
综合防控策略结合预防、监测与治理,是降低锶同位素危害的关键。
