化学 『元素笔记』 s 区元素、稀有气体
返回导航帖:ZnTellurium PostMap (ID 64888)
这篇我暑假做的笔记... 它的重点还是不太突出。为了解决这个问题,我会在每张图下方进行一
定的补充说明。这是因为原来的 INK 文件遗失了,而且就算没有遗失,重新上传所有的内容也
是一件很麻烦的事情。所以我不会改动原有的内容,只是做一定的补充,这样也更节省时间。
所有的附注,都是 2026 年添加的。
----=================================----
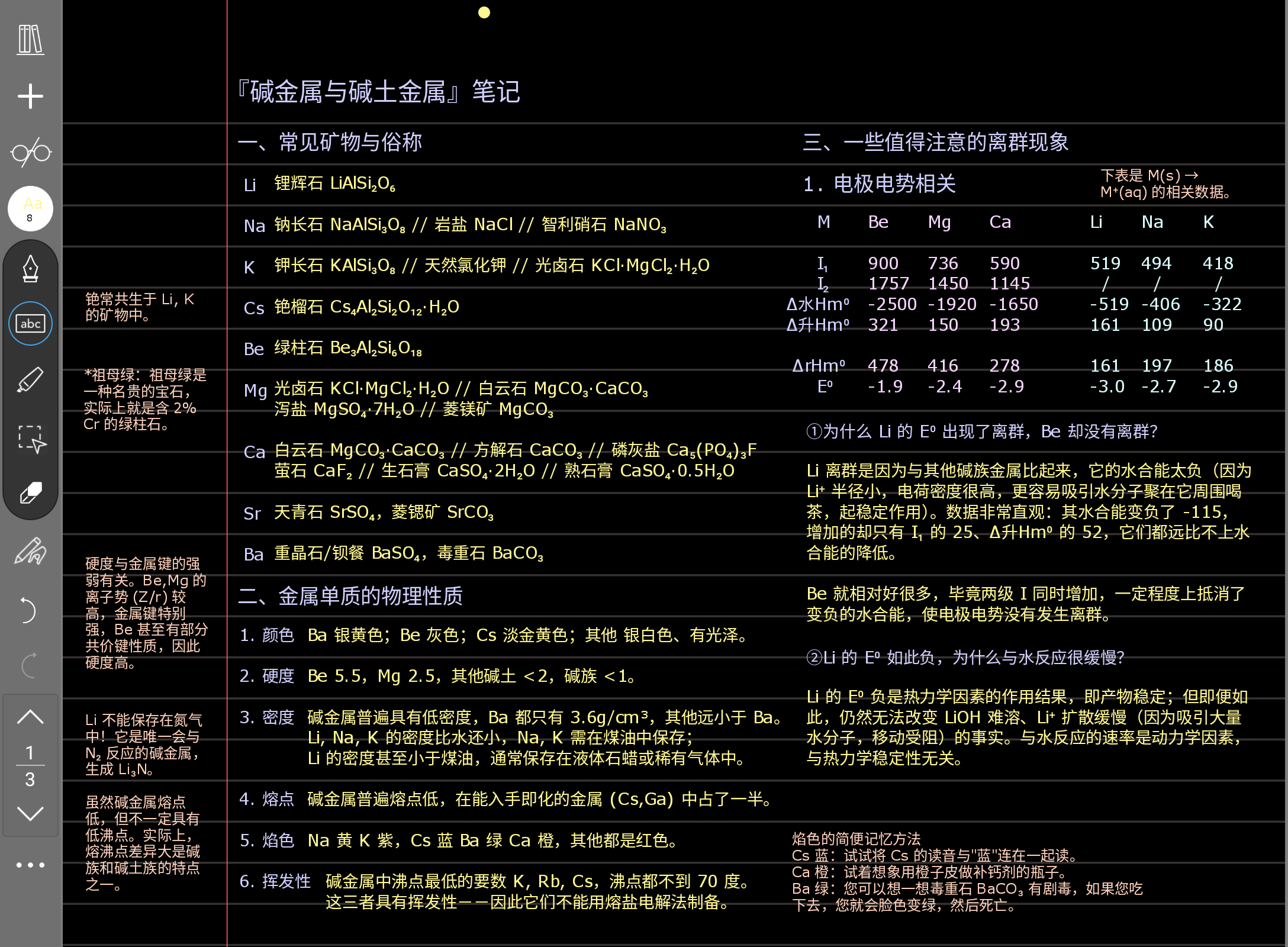
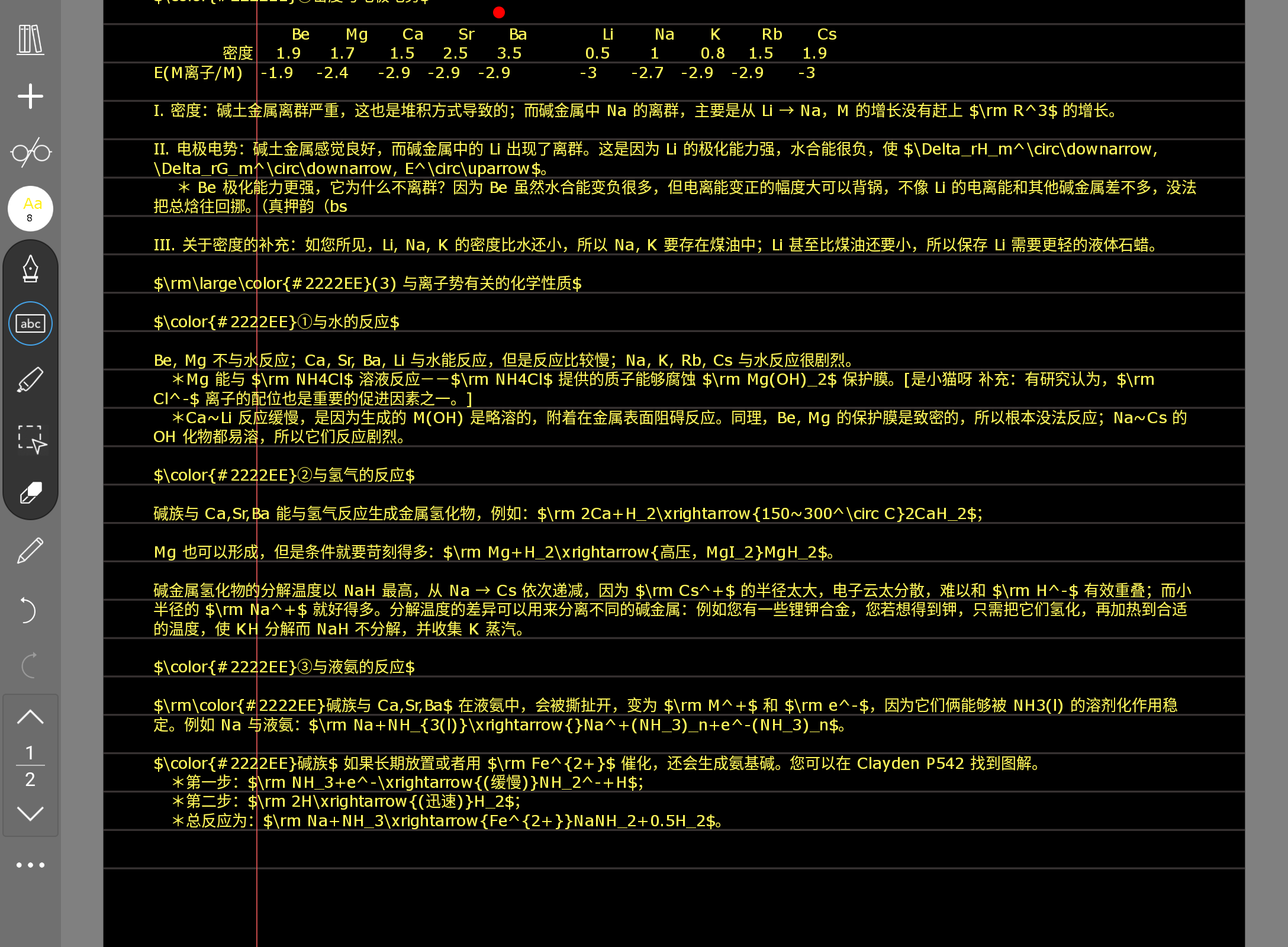
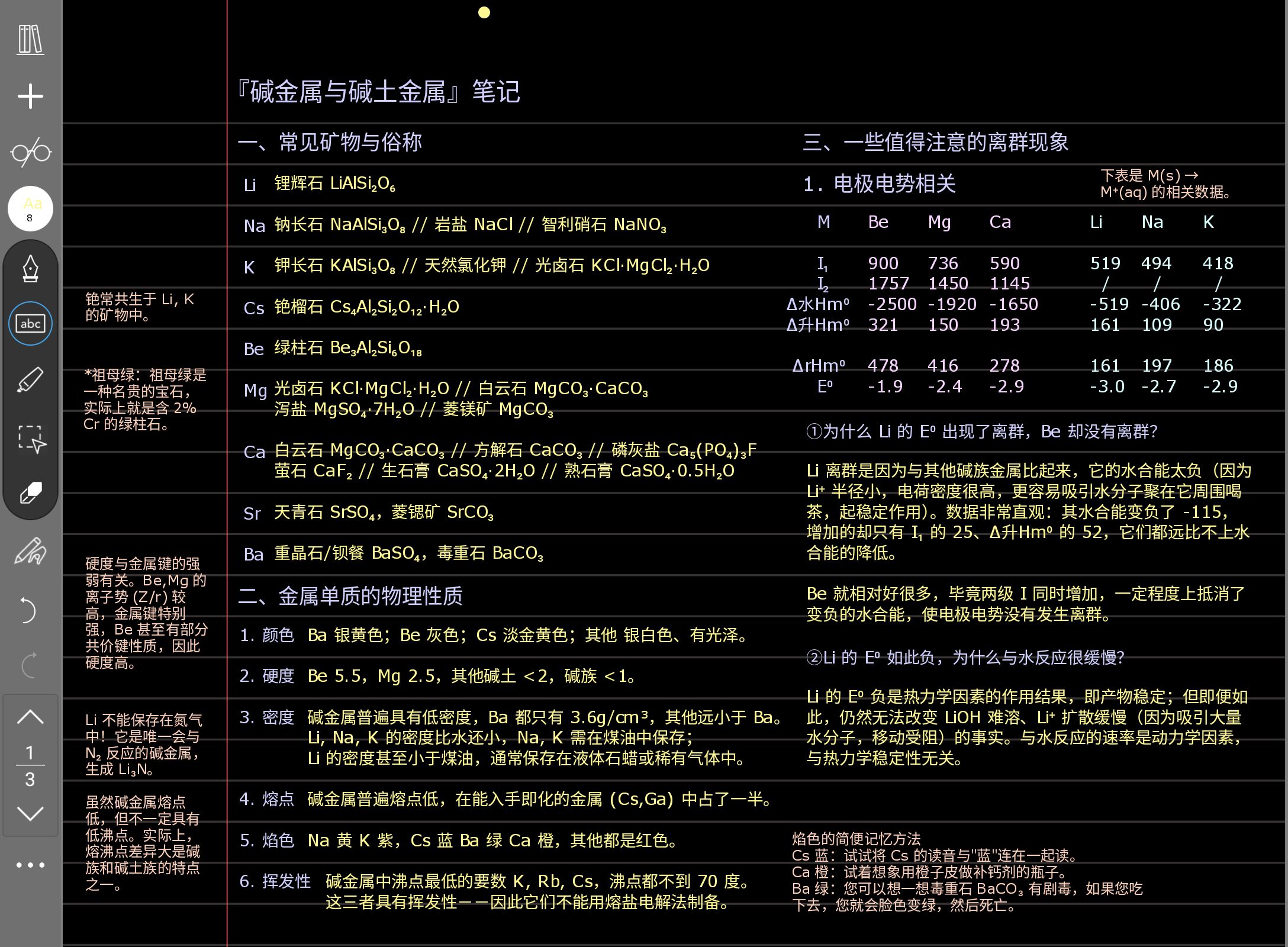
这一页的重点是第三个大标题 三、一些值得注意的离群现象。一般来讲,这种原理性的东西是现在国初爱考的,单纯考性质我觉得好像是在弱化的,就比如说它已经不会给你出那种判断错中心元素满盘皆输的题了,所以现在对元素性质的记忆其实没有几年前那么重要。最好还是多关注现象背后的原理。所以在后面看到什么原理解释都要格外认真地去对待它。
这里有一个要补充的点。关于硬度与金属键的强度有关,您之后学过渡金属的时候会发现,过渡金属的硬度、熔点、沸点、升华焓,它们差不多是同增同减的,为什么呢?这就是因为金属键强度很大程度上决定了过渡金属的这些性质,它是一个万能的决定因素。
您可以打开 ptable.com,然后看一看硬度、熔点、沸点的分布图。您会发现它们很相似。
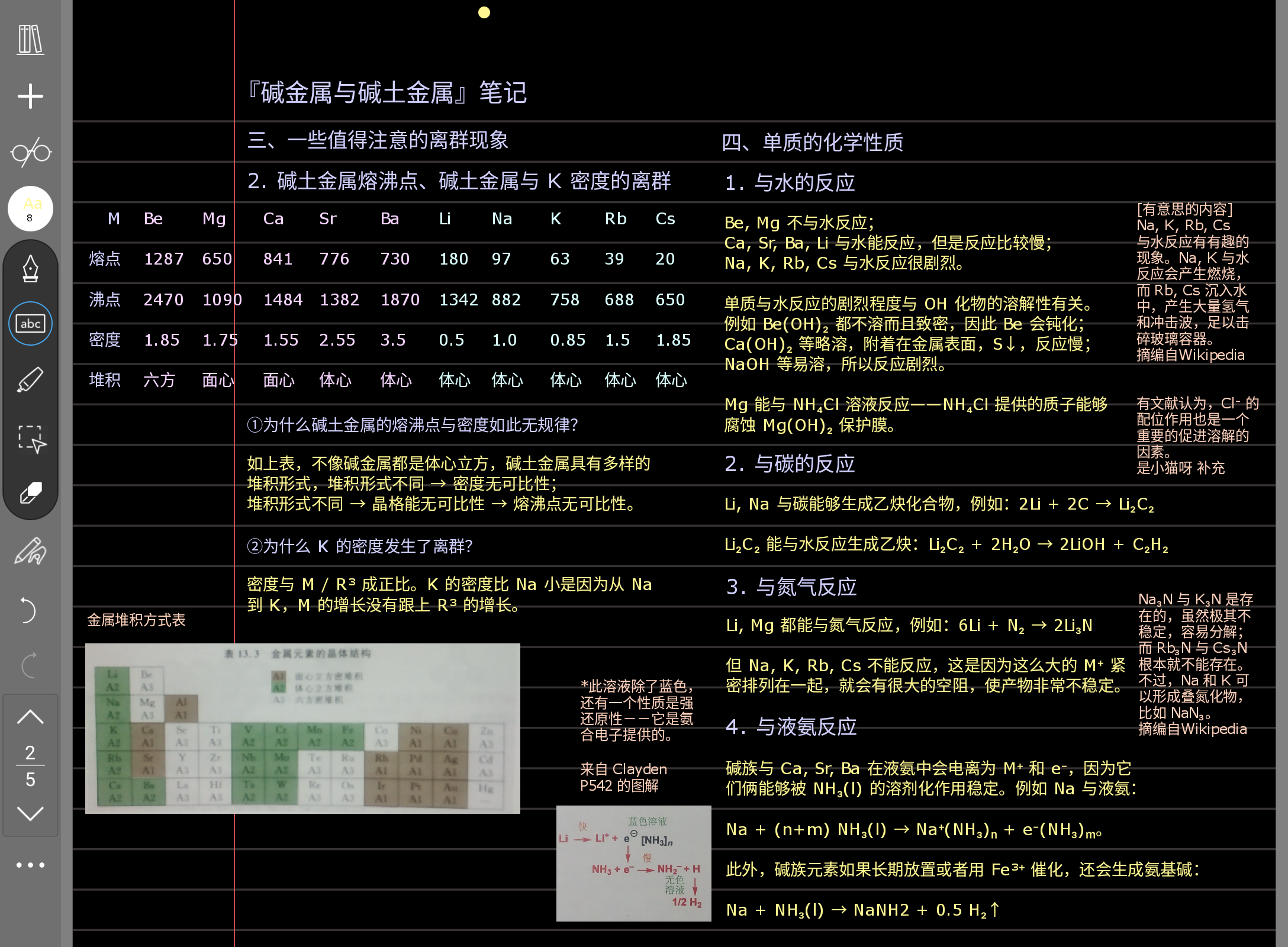
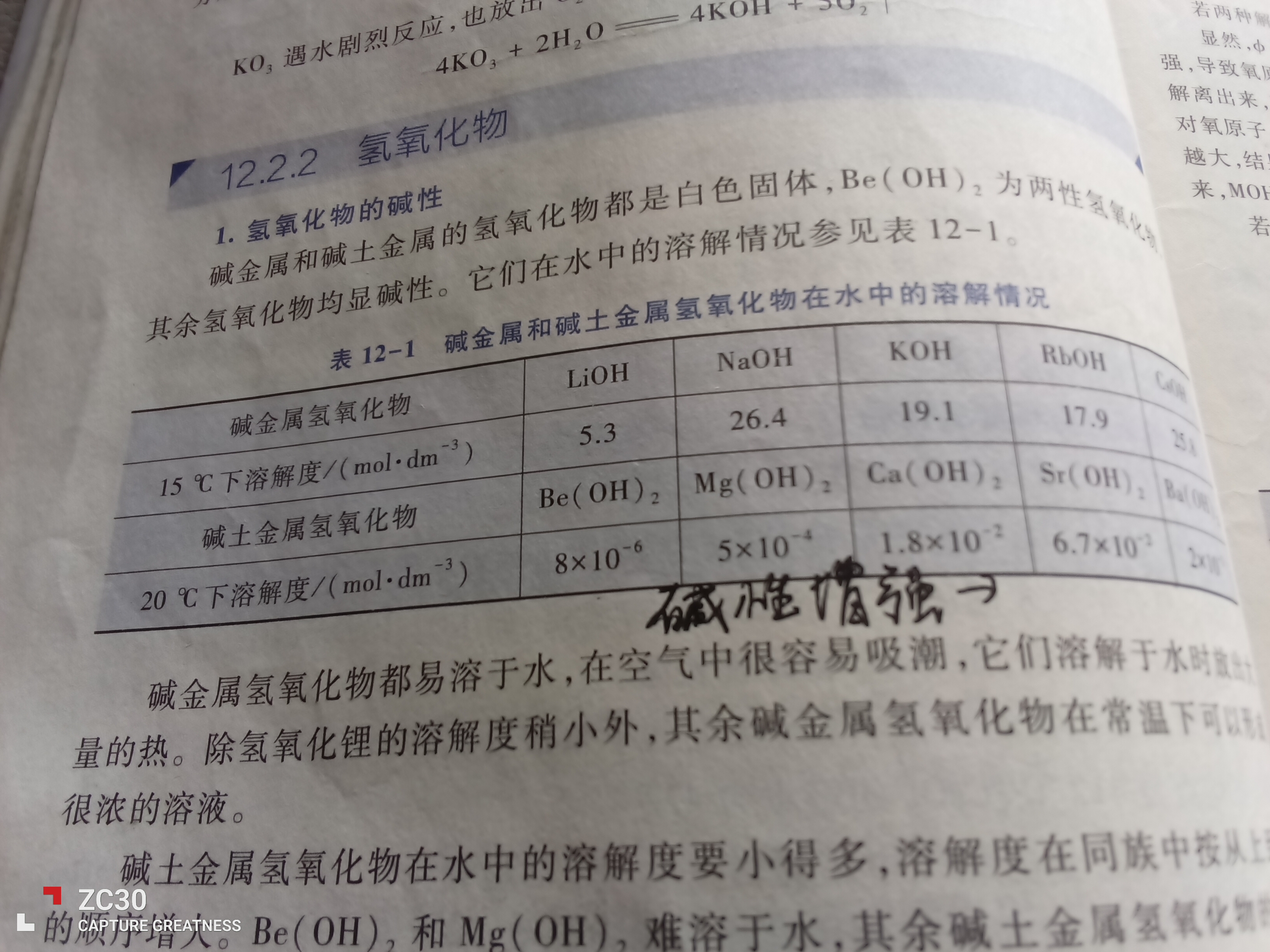
这里有一个勘误:LiCl 不溶,纯粹是扩散慢的问题,与溶解性无关,因为 LiOH 是易溶的。不过您记不住这个也没关系。
这一页里面离群现象还是重点。除此之外与水的反应性我觉得是重点,要记一下它的热动力学解释。
如果别的也想记,那么第四点与液氨反应里面,您可以类比一下水,这样会好记一些。因为水实际上就是 O 的液体氢化物,液氨则是 N 的液体氢化物,它们是有一定的相似性在的。
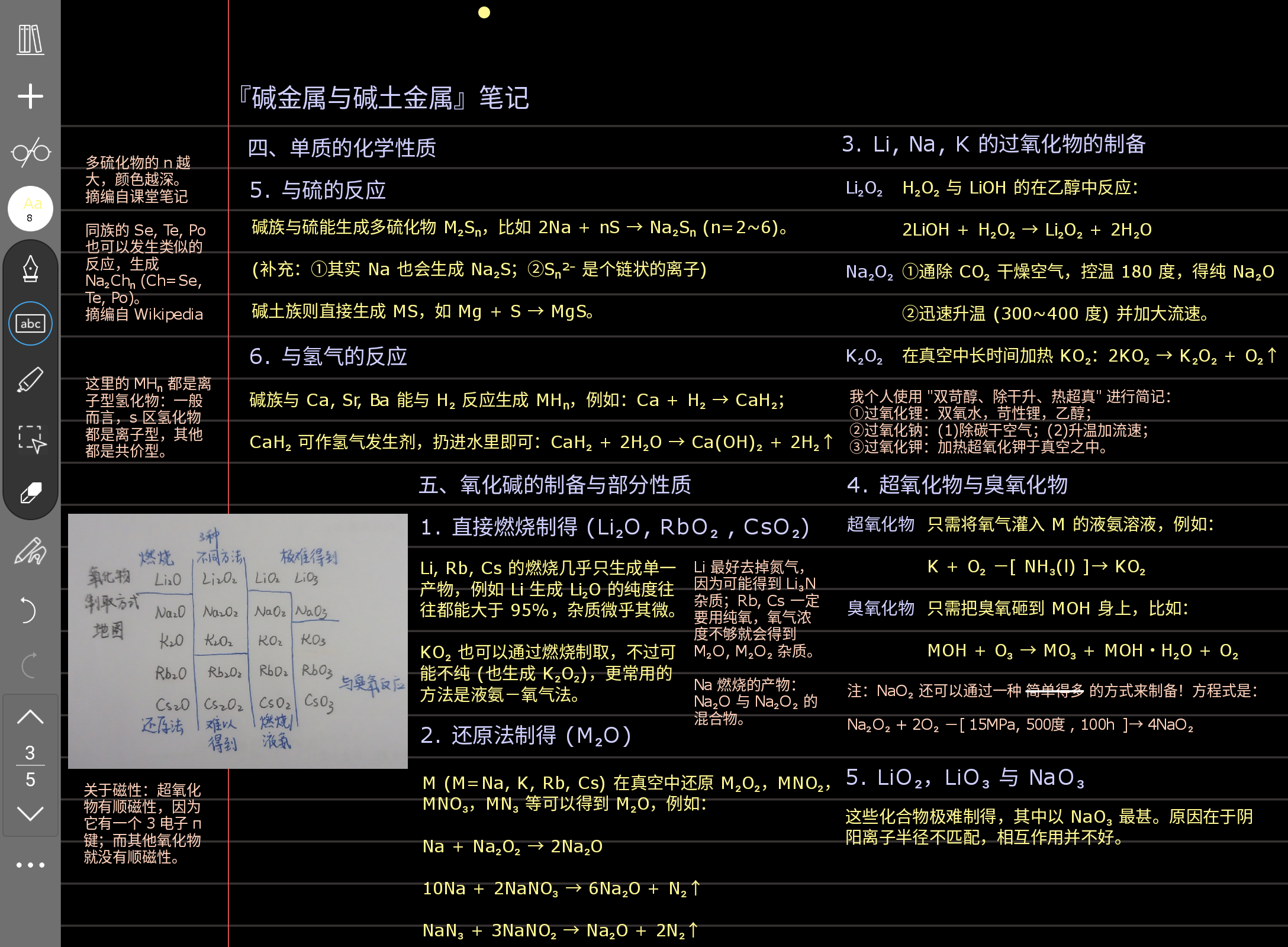
这页有点太详细了一点,我建议您去看普化,或者别的什么教材,不用记得太牢,因为它们都只是现象而已,理论解释很少,要主次有度。其实这两页您只要看了,知道怎么解释就好,不用记住,因为我的印象里这并不是热点。下面那个补充页也一样。
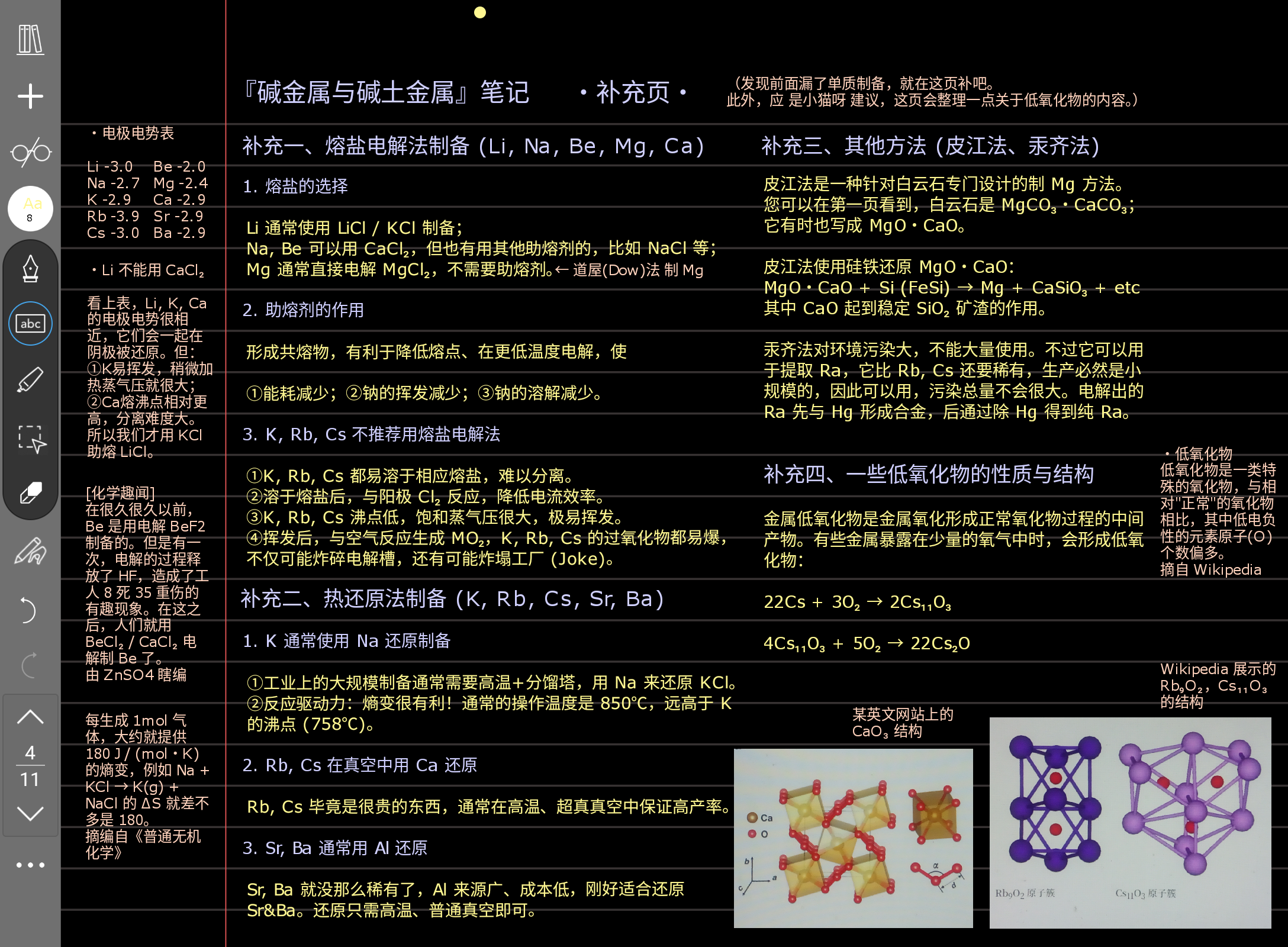
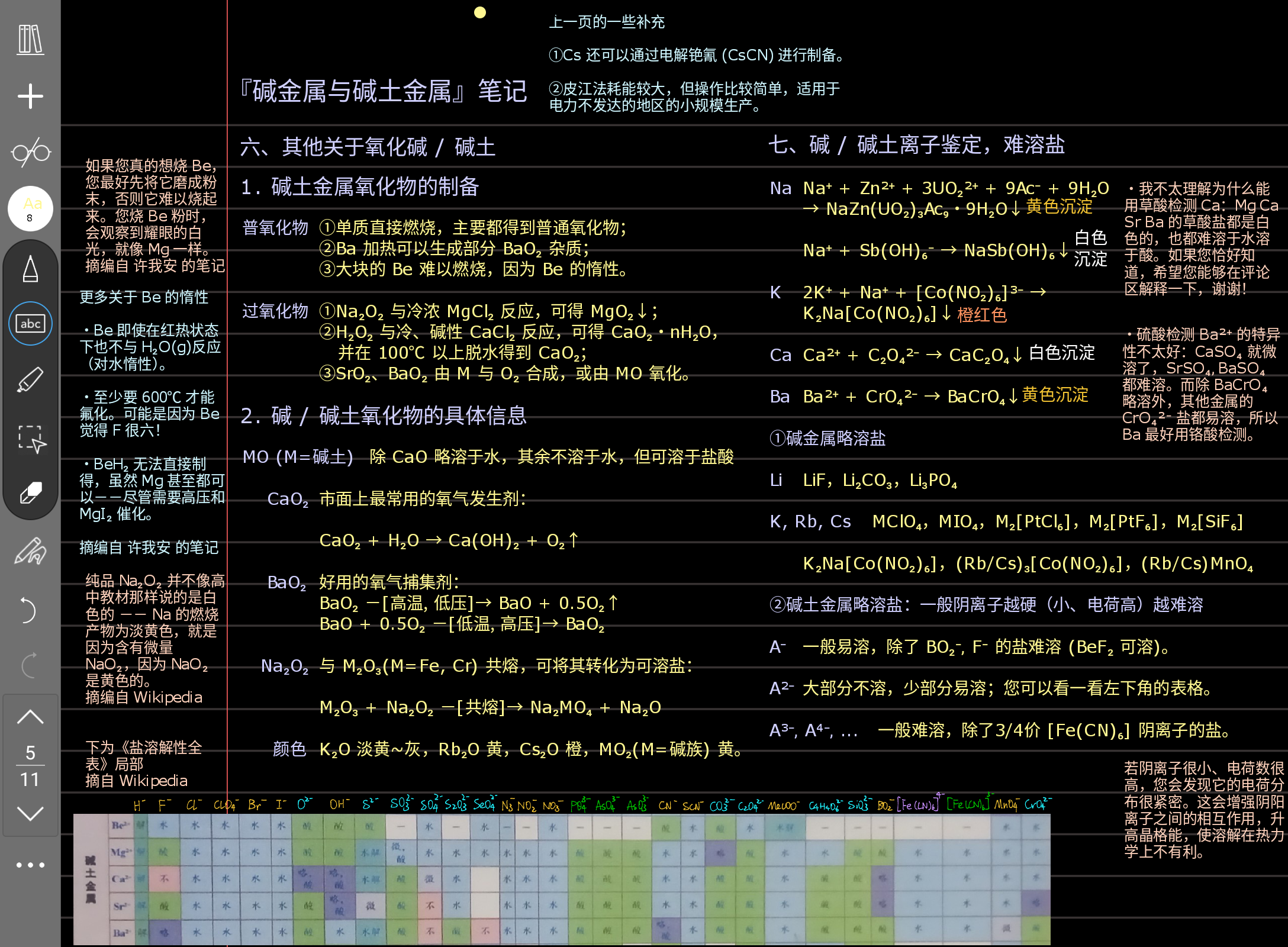
鉴定最好要记一下。然后右下角的解释很重要,它是判断盐溶解性的普遍规律。这里碱土金属是很硬 (硬就是电荷分布很密集,半径越小、电荷越高电荷就越密集,也就越硬) 的离子,如果阴离子也很硬 (比如半径很小的 F⁻,O²⁻,或者说半径大一点但是有三个负电的 PO₄³⁻),那么硬 + 硬,形成的晶体就很稳定,不容易被水击垮溶解 (溶解性小)。您可以想象一下搭积木,积木都差不多大那当然很好搭起来,如果有的大得像拳头有的小得像米粒那当然搭不起来,所以软硬匹配有利于晶体稳定。

BeCl₂ 固体的结构是一个很典型的东西,这样一个链条型结构是很常见的,您可以把它多画几遍。
『碱金属与碱土金属』画廊

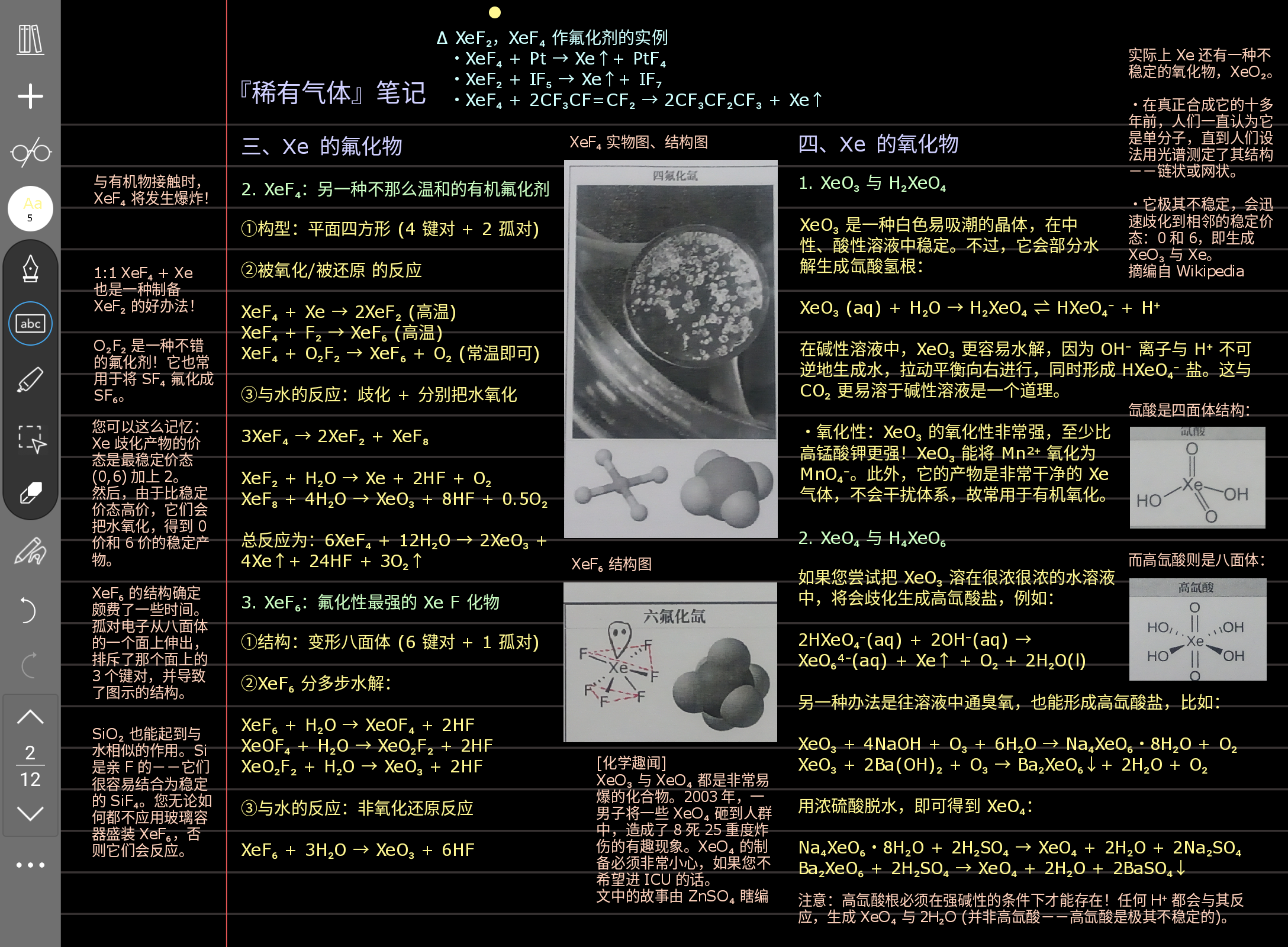
稀有气体基本上都不重要,有时间就看,没时间就过吧。这玩意普无上讲都没讲

『稀有气体与氢』画廊