物理 海朔·八水合过氧化钠对于芳香性的总结
最后一次更新:2025.8.2 01:34
更新了一点点稠环芳香性
-------------------------------------------------------------------分割线-------------------------------------------------------------------
由于过氧最近在论坛放了太多水,导致我的赞藏比从5:1爆涨到6:1
不行!不能再水了!为了降低论坛的水量,我选择

hhh开玩笑的
今天晚上,一个板砖(划掉)平板,一个过氧化物,我要更新化学!
-------------------------------------------------------------------分割线-------------------------------------------------------------------
芳香性最初发现于苯(benzene)及其衍生物,当时是用来描述它们特殊的气味以及易取代不易加成的特性
但现在,芳香性的定义已经与气味无关
具有芳香性的物质有特殊的、出乎意料的稳定性
举一个老掉牙的例子
众所周知,烯烃的加氢过程是放热的,而1,3-环己二烯可以在高温脱氢生成苯,这个反应居然会放出一些热量!
什么物质具有芳香性?芳香性物质具有什么特殊的性质?为什么?这样特殊的稳定性有强弱之分吗?如果有,为什么?
这就是本文要讲的内容
$Huge{一、芳香性(Aromaticity)的判定}$
在介绍芳香性之前,首先要介绍一下反芳香性(antiaromaticity)与无芳香性(non-aromaticity)
一般来说,需要我们讨论芳香性的物质有以下几个特点:
1)有含有共轭双键的环系结构
2)环上每个原子皆有未杂化的p轨道
3)这些轨道形成了一个连续、重叠、平行轨道的环系(因此这些环一般是平面的)
有芳香性的物质往往有这些特点,并且π电子完全离域使物质比开链的稳定
同样,具有类似结构的共轭体系,若成环比不成环稳定,则成环的有芳香性
有反芳香性的物质往往也有这些特点,π电子也完全离域,但这使物质变得比开链的不稳定
同样,具有类似结构的共轭体系,若成环比不成环不稳定,则成环的有反芳香性
而无芳香性的物质没有全部满足这些特点,不会使物质的稳定性发生改变
1、分子轨道理论(Molecular Orbital Theory)(以下简称MO),最朴素的芳香性判定方法
化学中的理论千千万,然而如果想用它们去解释实验事实,能用的恐怕一个手都能数得出来
就比如我们想解释苯很稳定,而环丁二烯(cyclobutadiene)很活泼时,好用的共振论就突然不香了
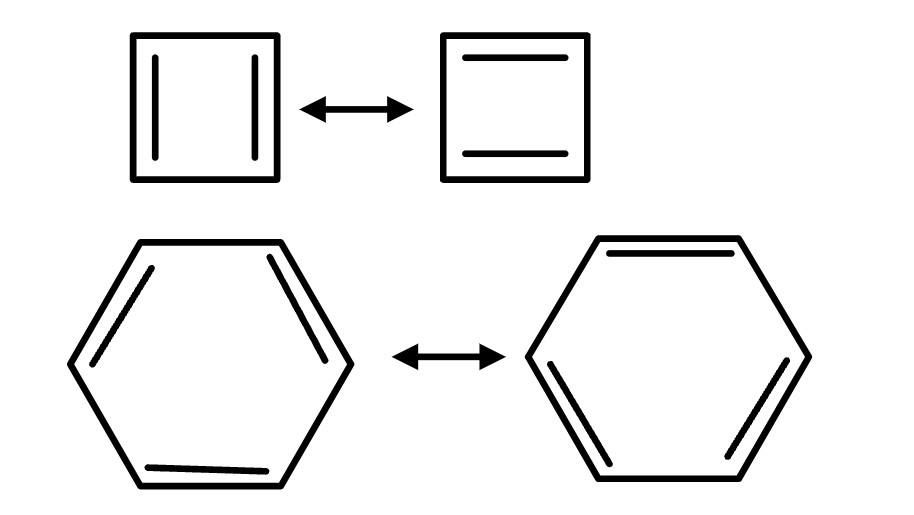
可以看到,苯和环丁二烯的共振式非常像,所以不能使用共振式来解释这个事实
但我们可以使用MO来解决这个问题
我们可以很容易地画出苯和环丁二烯的MO:(图片来源:210讲义)
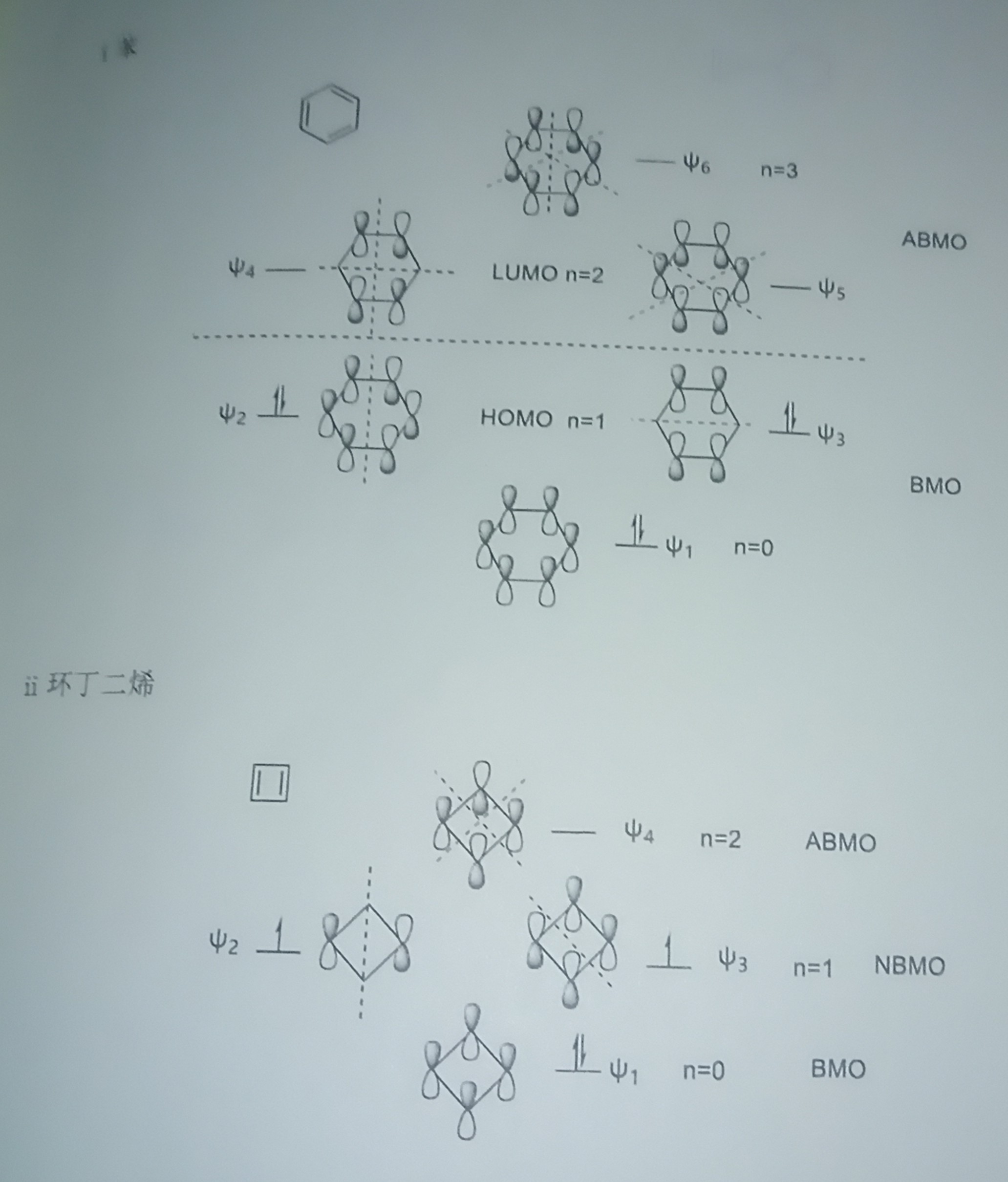
从中可以发现,苯的6个π电子填满了苯分子的成键轨道(Bonding Molecular Orbital)(BMO)
而环丁二烯占满了BMO,非键轨道(Non-bonding Molecular Orbital)(NBMO)半满,两个非键轨道各有一个单电子
这单电子就很令环丁二烯难受,这两个轨道作为HOMO,环丁二烯有一种极强的倾向去丢掉这两个轨道上的电子,或接受两个电子使它们全满
这就使环丁二烯远远不如苯稳定
我们可以画出苯和开链的己三烯的MO:(图片来源:巨本)
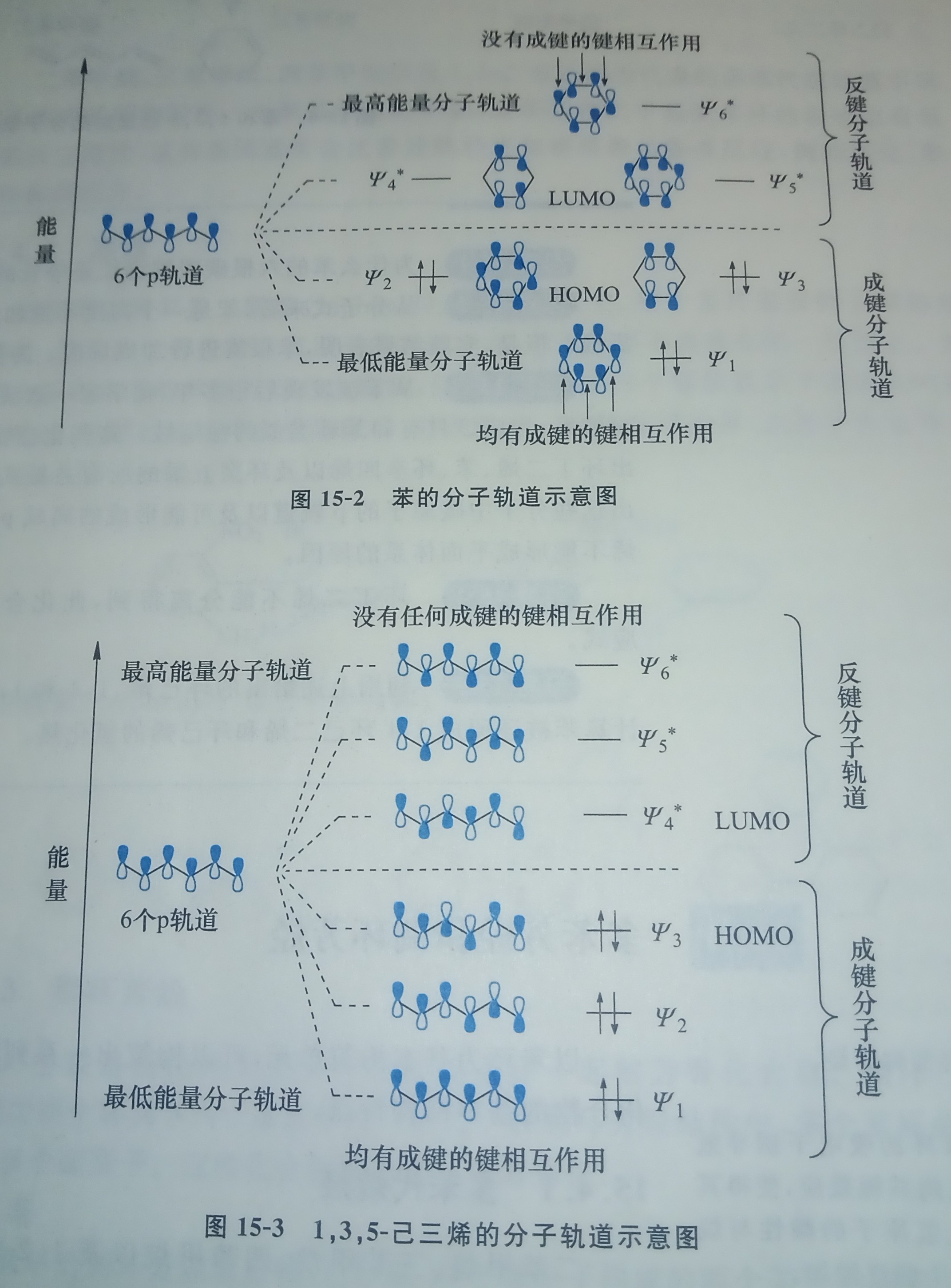
可以发现,苯的Ψ1,Ψ2比己三烯的Ψ1,Ψ2能量低,苯的Ψ3比己三烯的Ψ3的能量略高
总的来说,苯的MO的能量比己三烯的低不少
根据芳香性的定义,苯具有芳香性
同样也可以写出环丁二烯和开链丁二烯的MO(过氧懒得画了)
可以发现环丁二烯NBMO上的两个单电子严重抬高了环丁二烯MO的能量
使环丁二烯的稳定性不如开链的丁二烯
所以环丁二烯具有反芳香性
回到第一张图,可以发现,若想使这样的分子有芳香性,则它们的BMO或BMO+NBMO必须全满
而这样的分子中,根据MO的思想,BMO总是有奇数个
设有2n+1个,则占满BMO及BMO+NBMO所需要的π电子数可以分别表示为4n+2和4(n+1)+2(n为任意正整数)
由于n是一个正整数,所以n+1也是正整数,4(n+1)+2也是一种4n+2
如果想使这样的分子有反芳香性,则它的HOMO(可以在NBMO或ABMO)必须半满
则它的π电子数可表示为4(n+1)或4(n+2)(n为任意正整数)
这两种情况都可以表示为4n
总结一下,有4n+2个π电子的平面环状共轭体系有芳香性,有4n个π电子的有反芳香性,若分子没有平面环状共轭体系则无芳香性
2、Huckel规则----------判断平面环状共轭体系为芳香性or反芳香性的捷径
1931年,E.Huckel(休克尔)提出了一条芳香性判断规则-----------著名的Huckel规则(不得不说Huckel是真的厉害)
Huckel规则是判断轮烯(annulene)及其类似物与衍生物的捷径
由于它是一条经验规则(当年MO都没有被提出),所以被判断的物质必须含有平面环状共轭体系
该规则认为,在这样的物质中,具有4n+2个π电子的具有芳香性,具有4n个π电子的具有反芳香性
该规则的本质就是之前讲的MO
现在我们来判断几个物质是芳香性or反芳香性or无芳香性
(1)苯:6个π电子,4n+2,无需多言
苯的碳碳键角是完美的120°,也是它如此稳定的另一个原因
(2)环丁二烯:4个π电子,4n,反芳香性
事实上,环丁二烯为了削弱反芳香性,其分子结构为长方形,π电子未完全离域
环丁二烯不稳定的另一个原因是极大的环张力
它很活泼,寿命只有5秒
但以环丁二烯作为π配体的物质还是可以稳定存在的,比如$Fe(CO)_3(η^4-C_4H_4)$
在这个配合物中,环丁二烯带两个负电荷,具有芳香性
(3)环辛四烯:8个π电子,4n,反芳香性?无芳香性!
为什么是无芳香性呢?因为环辛四烯不是平面分子
为了防止反芳香性并减轻双键的大环张力,它采取了澡盆型的构型
它的化学性质与普通的烯烃无异,可以正常被高锰酸钾氧化,被溴加成,发生 Diels-Alder反应
但如果向里面加钠!!!加加加加加到厌倦!!!或者使用五氟化锑+氟氯化砜氧化
可以分别得到环辛四烯的双负离子与双正离子
这两个离子分别有10个和6个π电子,均具有芳香性
(4)两种[10]-轮烯:4n+2,但不共平面,无芳香性!
[10]-轮烯有两种代表性的异构体:(如图所示)
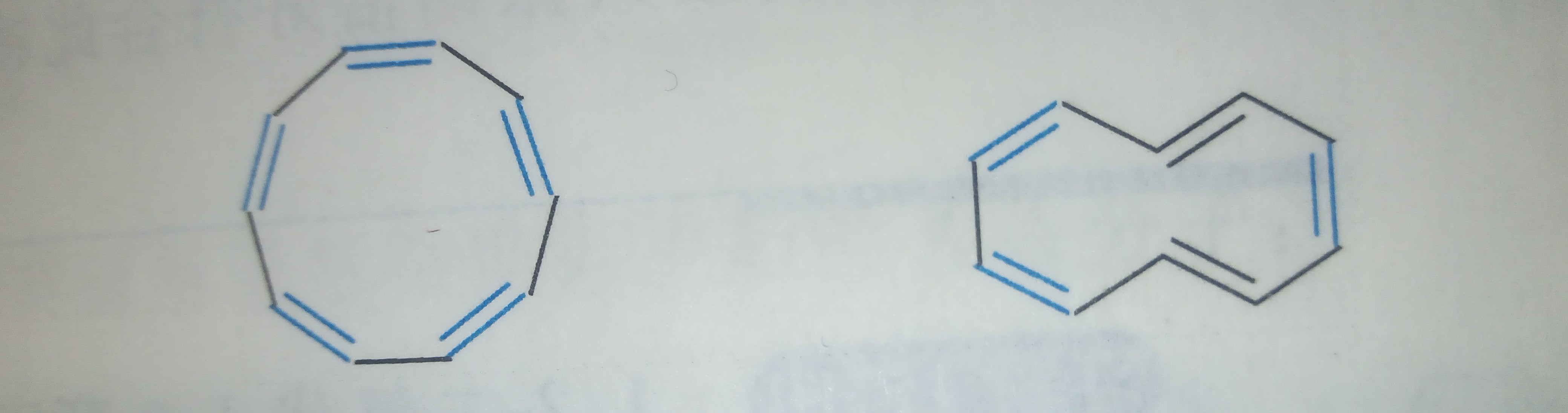
由于大环张力,第一种[10]-轮烯不能使所有碳原子共平面,就没有芳香性
第二种[10]-轮烯由于内氢重叠,很不稳定,容易被氧化生成萘(naphthalene)或对旋关环
但是,如果把这两个氢换成一个亚甲基,就可以避免内氢的空阻,得到芳香性的物质
这种改进方法也适用于其他内氢重叠的4n+2轮烯
(5)更大的4n轮烯
由于环的扩张,环的刚性减小,这样的轮烯为避免反芳香性,会弯曲生成无芳香性的物质
(6)更大的4n+2轮烯
除了一些像之前介绍的内氢重叠的轮烯,更大的4n+2轮烯均有芳香性
(7)茂负离子(cyclopentadienyl anion)
环戊二烯基负离子,简称茂负离子,有6个π电子,有芳香性
不仅如此,它的键角为108°,很接近120°,也是它稳定的另一个原因
它和铁可以形成非常稳定的夹心配合物----------著名的二茂铁(ferrocene)
二茂铁是橙黄色固体,其分子高度对称,十根碳-铁键的键长均相等
该化合物具有极高的热稳定性与化学稳定性,可以发生芳烃发生的反应
注意!茂负离子虽然稳定,但也跟正常的负离子一样,具有亲核性
茂负离子显强碱性,会正常地与水反应
(8)䓬正离子(tropylium cation)与环丙烯正离子
环庚三烯基正离子,简称䓬正离子,可以通过用稀硫酸处理环庚三烯醇来制备,有6个π电子,有芳香性
一个重要的类似物质(也是䓬正离子的词源)叫做䓬酚酮(2-羟基-2,4,6-环庚三烯-1-酮)
该物质可以形成分子内氢键,氧这边略带负电,环庚三烯环略带正电,形成芳香性的䓬正离子
该物质的化学性质很像苯酚
环丙烯正离子,是最小的芳香性体系,有2个π电子,有芳香性
注意!它俩也有碳正离子的通性:强的Lewis酸性和亲电性
然而,Huckel规则不是万能的,有些东西是这条规则解释不了的
3、Hückel规则判断不了的芳香性
由于Hückel规则是一条经验规则,它只能判断轮烯及其类似物的芳香性
如果我们想要判断的分子不是轮烯及其类似物,这条规则就显得有些无能为力了
接下来过氧要介绍同芳香性、稠环芳香性、富瓦烯类化合物的芳香性、杂环芳香性
甚至更加神奇的球面芳香性、Möbius芳香性、以及突破芳香性定义的Y芳香性和σ芳香性等等
(1)同芳香性(homoaromaticity)
在研究芳香性的过程中,科学家们发现:
有些环状化合物的共轭体系虽然被一个或更多sp³碳所打断,但仍然有一些特殊的物化性质
这个现象表明,这样的π共轭体系的中断处可谓藕断丝连,仍然通过p轨道的重叠使共轭体系得以延续
这就使这样的体系仍然有类似芳香性体系的特殊物化性质
于是,S.Winstein就在研究3-二环[3.1.0]环己基正离子时提出了同芳香性的概念
此后,该概念迅速发展
如今,同芳香性成为了一种特殊的芳香性,存在于被一个或多个sp³碳打断的的共轭体系中
同芳香性的产生基于同共轭效应,这种效应就是刚才所说的共轭体系通过p轨道的重叠使共轭体系延续
这种重叠非常特殊,可以跨越一个或几个sp³碳,其重叠力度介于σ键与π键之间
通过这样的重叠就可以形成一个类似平面共轭轮烯的体系,就可以使用Hückel规则进行判断了:
如果有4n个π电子在同芳香性体系中共轭,则该体系具有同反芳香性
如果有4n+2个π电子在$同芳香性体系$中共轭,则该体系具有同芳香性
1995年,R.F.Childs等人提出了同芳香性的基本标准:(以下内容来源于巨本)
1)体系中必须有一个或多个同共轭作用
2)同共轭作用应当比较显著,对于有σ键的同芳香性应具有部分键级,对于空间作用而言,同芳香性则必须有明显的空间相关作用
3)体系中电子的离域应当使化合物产生类似芳香性的特征,如键长平均化、π轨道的有效重叠、正/负电荷的分散以及键级的变化
4)符合4n+2规则
5)由同芳香性产生的稳定化能应不小于8.4kJ·mol⁻¹
(这一条很重要,因为同共轭次数越多,中间的sp³碳就越多,同共轭效果就越差,直到稳定化能小于8.4kJ·mol⁻¹而不能形成同芳香性体系)
6)具有芳香化合物的磁学性质(过氧以后会讲)
这条规则已经被科学家普遍接受,同芳香性的研究也从正离子推广到更多物质
(2)稠环化合物的芳香性及强弱比较
轮烯可以通过各种方式并接,形成稠环化合物,这些化合物的结构不符合Hückel规则的判断前提,所以不能直接使用它来判断此类物质的芳香性
1)仅有苯环的稠环化合物的芳香性及其比较 Clar规则
苯作为一种轮烯和六边形分子,可以像铺瓷砖似的以多种方式并接
苯有芳香性,所以这样的化合物肯定有芳香性,但π电子不一定符合4n+2规则
比如芘有16个π电子,蒄有24个π电子
但事实上,它俩都很稳定
如果我们想要判断这样的化合物的整体芳香性,只需要看最外面的一个大环就行了
比如芘最外面的大环有14个π电子,蒄最外面的大环有18个π电子,均符合Hückel规则
所以它们具有芳香性
但是!这类物质的稳定性差异很大!
比如同为有七个苯环的芳烃,蒄像一面盾牌,稳如磐石,而并七苯很活泼,很容易被各种氧化剂氧化
为什么呢?我们可以使用共振论来解释:
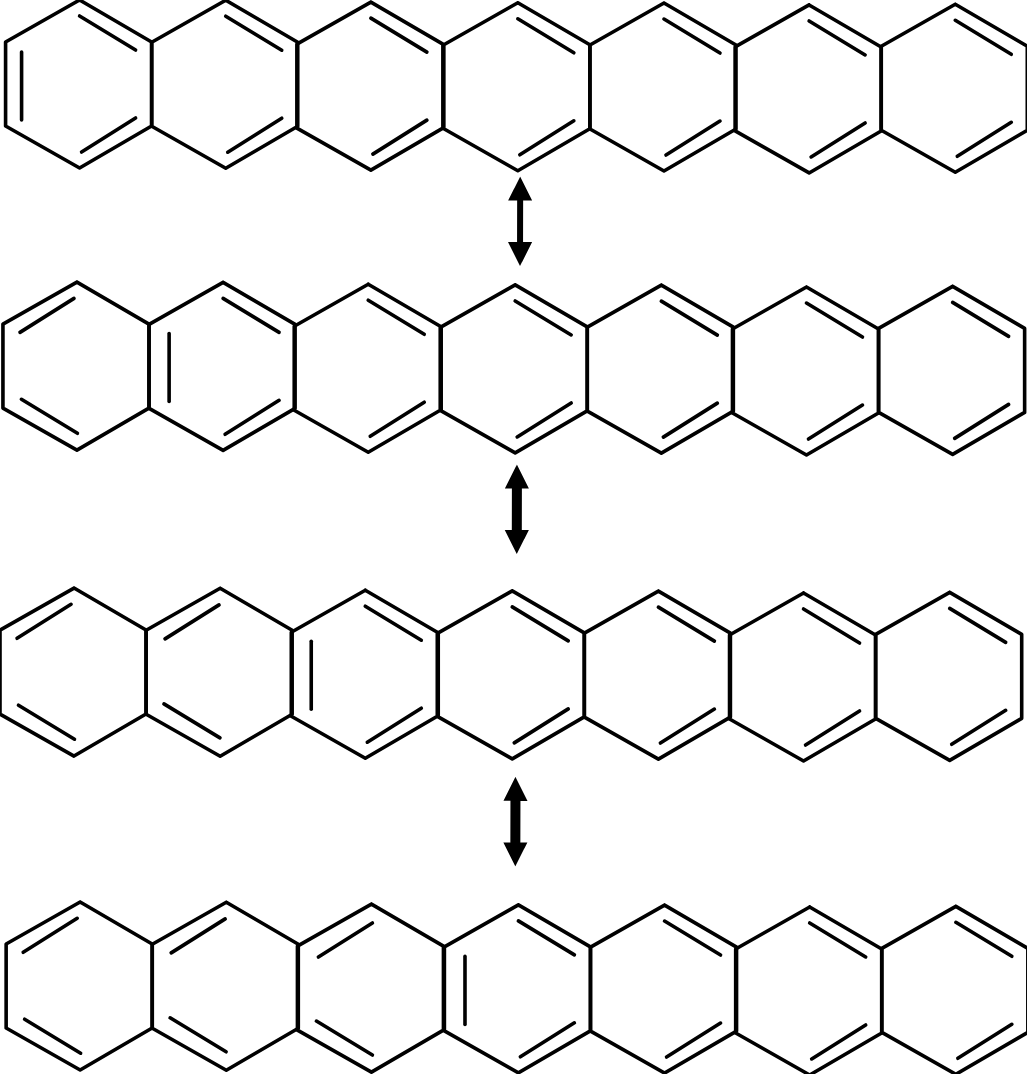
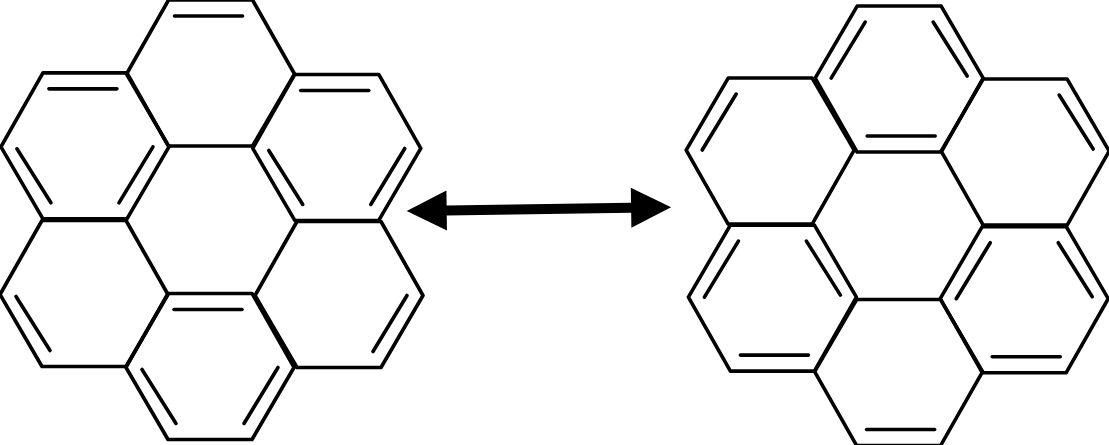
可以发现,并七苯无论在哪个共振式中,都只有一个完整苯环,而稳定的蒄在每个共振式中,都有三个完整苯环
这就解释了这两种物质的稳定性差异
波兰化学家Erich Clar整合实验数据以及理论分析,提出了以这种比较方法为基础的Clar规则
未完待续……
