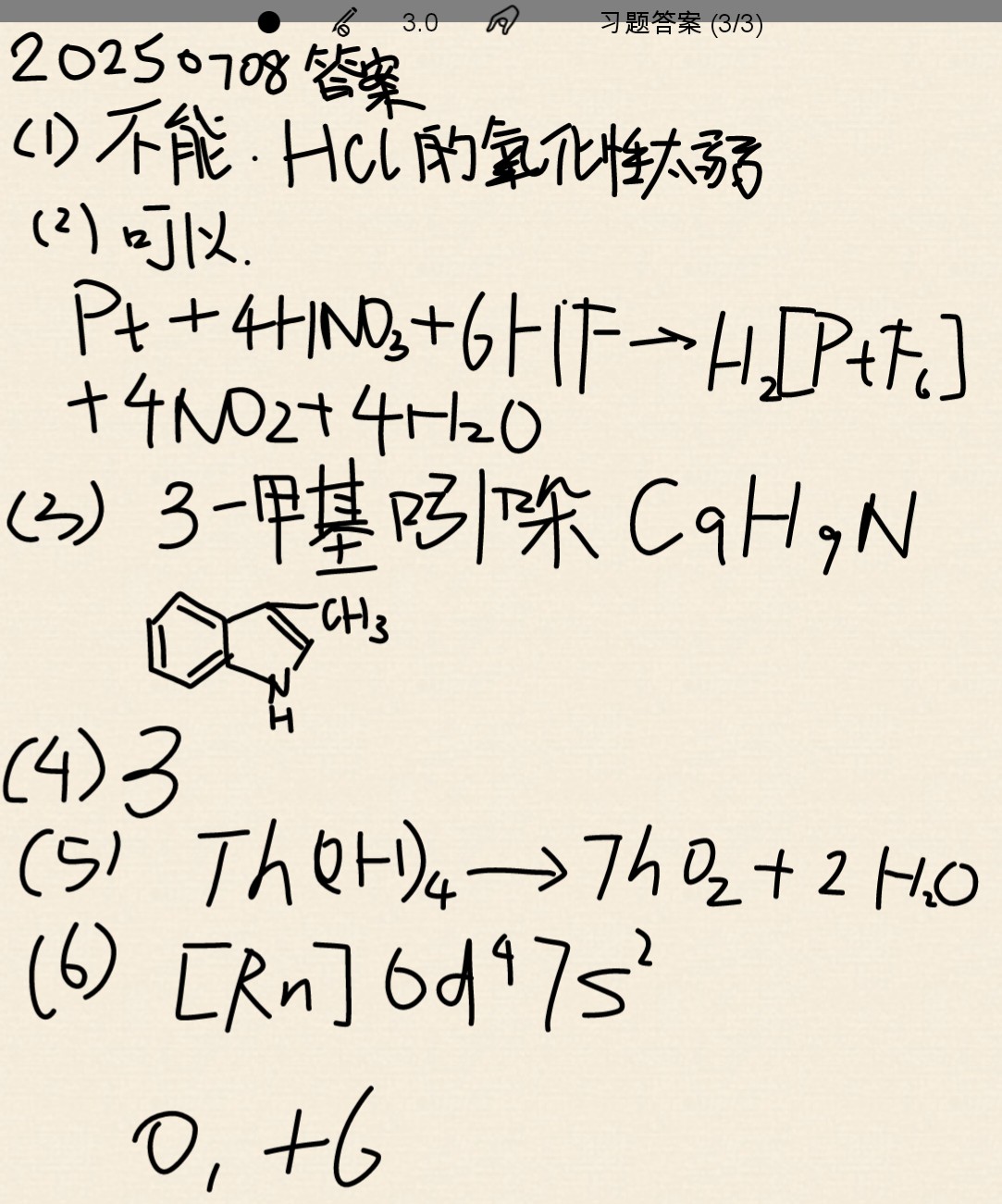
化学 物质的分类(obox猫猫虫)

请看上图
$\color{red}{1:主族元素和副族元素}$
主族元素一般指元素周期表中的A 族(IA~VIIA,0族),这些元素除0族元素外所有元素较为活泼,价态相对较少,大部分可以显负价。
负族元素一般指元素周期表中的B 族(IB~VIIIB)这些元素全是金属,化学性质较主族元素不太活泼,价态多而广,非极端情况不显负价。
$\color{red}{2:s 区元素}$
s 区元素为图中橙色、黄色区域以及1、2号元素(有教材上s区不考虑氦),这些元素最外层只有1~2个电子,因此除氦以外所有s区元素都极为活泼。它们都可以形成多种氧化物。还可以在某些化合物诸如金化铯$Cs_3Au$等形成-1价态。s 区金属极易形成盐类。
$\color{red}{3:p区元素}$
p区元素为图中深绿色(不含氢)、深蓝色、浅蓝色、白色(不含氦)区域。非金属元素中的90%以上都在该区域。这些元素除3A4A 金属以外全都可以形成负价。最常见的形如胂$AsH_3$。这些元素价态一般较少,较为固定,不容易急速变价,且该区域内大部分元素活泼,易燃。
$\color{red}{4:d区元素}$
d区元素为图中粉色区域。d区内全是金属,也全是过渡金属,全是副族元素,都有很多价态,空气中很难剧烈燃烧,但化合物有的活泼。该区域内金属形成的强碱全是微溶级别以下的弱碱,这些金属离子颜色千奇百怪五颜六色,全都是因为未成对电子的原因。该区域内金属密度大,全不与水反应,除铁、铜、钛除外所有物质价格偏贵。
$\color{red}{5:f区元素}$
f区元素为图中浅绿色区域。f区内全是活泼金属,全是镧系、锕系金属。锕系金属及镧系中钷具有放射性。镧系金属化合价较少,只有0,+2,+3,+4价。其中每个镧系、锕系金属都会显0,+3价。锕系金属价态更多,例如+2,+3,+4,+5,+6。
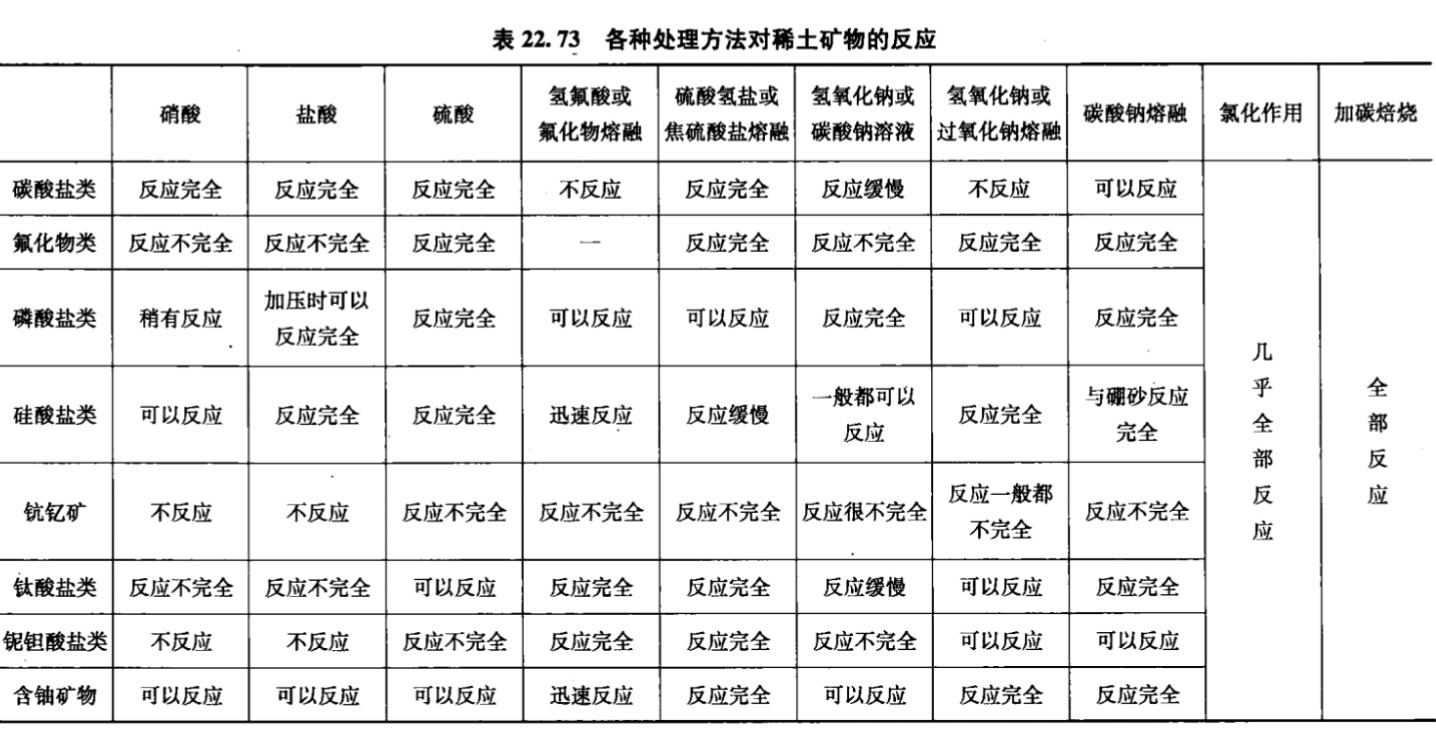
$\color{red}{6:稀土元素}$
稀土元素指镧系元素和钪、钇,这些元素一般100¥/g,显+3价和0价最为常见,另外还可以有+2或+4,但是极为稀少。一般在提纯时耗费的人力物力巨大。另外这些元素无一不活泼,就像纯净的铈$Ce$粉在空气中轻轻摩擦即可自燃。大部分稀土元素可以和热水反应生成对应难溶弱碱。
$\color{red}{7:卤素}$
卤素指氟、氯、溴、碘、砹的统称,砹因为其放射性、极不稳定性不考虑。这些元素非常能抢夺电子。例如氟气和氢气混合立即发生爆炸。氯气和氢气也能直接反应。氟的非金属性最强。因此分离起来最难。卤素都含有-1价,且除氟以外所有卤素都能形成许多种价态。(砹未考证)另外卤素还有一种有意思的现象,就是靠上面的卤素可以把下方的卤素置换出来。例如氯气和溴化钾的反应:
方程式:$Cl_2+2KBr=2KCl+Br_2$
电离能他来啦!!!(全部手打)
注意这里的单位是KCAL/MOL不是KJ/MOL!!!!!!!!!!!!!!!
原子序数 元素符号 $I_1$ $I_2$
1 H 313 ////
2 He 567 1254
3 Li 124 1743
4 Be 215 420
5 B 191 580
6 C 260 562
7 N 335 682
8 O 314 809
9 F 402 806
10 Ne 497 947
11 Na 118 1090
12 Mg 176 347
13 Al 138 434
14 Si 188 377
15 P 242 455
16 S 240 539
17 Cl 300 549
18 Ar 363 637
19 K 100 733
20 Ca 141 274
21 Sc 151 295
22 Ti 157 313
23 V 155 338
24 Cr 156 380
25 Mn 171 360
26 Fe 181 373
27 Co 181 393
28 Ni 176 418
29 Cu 178 468
30 Zn 216 414
31Ga 138 473
32 Ge 182 367
33 As 226 429
34 Se 225 496
35 Br 273 498
36 Kr 323 566
37 Rb 96 634
38 Sr 131 254
39 Y 147 282
40 Zr 158 303
41Nb 159 330
42 Mo 164 372
43 Tc 168 352
44 Ru 170 386
45 Rh 172 417
46 Pd 192 448
47 Ag 175 495
48 Cd 207 390
49 In 133 435
50 Sn 169 337
51 ** 199 380
52 Te 208 429
53 I 241 440
54 Xe 280 489
55 Cs 90 579
56 Ba 120 231
----------
72 Hf 160 343
73 Ta 182 373
74 W 184 408
75 Re 181 383
76 Os 200 390
77 Ir 210 ???
78 Pt 210 428
79 Au 213 473
80 Hg 240 432
81 Tl 141 471
82 Pb 171 346
83 Bi 168 385
84 Po 194 ???
85 At ??? ???
86 Rn 248 ???
87 Fr ??? ???
88 Ra 122 234
元素周期表中因为镧系与锕系元素不常用,所以这里只列出La Ac进行参考
57 La 129 263
89 Ac 160(?) 280
$\Huge{\color{gold}{元素化学部分}}$
#####碱金属,碱土金属部分
提示:X 指碱金属,Y 指碱土金属
一提到碱金属,我们就会想到加$钠$,而众所周知,钠和其他许多碱金属都可以和水直接炸,原因是钠入水温度太高从而点燃了其生成的氢气。方程式如下:
$2X+2H_2O=2XOH+H_2$
在上一个部分,我们提到了这些金属的氢化物,合成氢化物的方程式为
$2X+H_2=2XH$
$Y+H_2=YH_2$
氢化物也可以与水反应。反应方程式如下:
$XH+H_2O=XOH+H_2$
$YH_2+2H_2O=Y(OH)_2+2H_2$
离子方程式:
$H^-+H_2O=OH^-+H_2$
碱,碱土金属的氧化物真的很多,下面就来一一介绍:
首先是最简单的
锂和碱土金属加热生成氧化物,方程式如下:
$4Li+O_2=2Li_2O$
$2Y+O_2=2YO$
其他碱金属自行在空气中常温氧化:
$4X+O_2=2X_2O$ (X 不含Li)
除铍外的XY 在燃烧条件下形成过氧化物($X_2O_2,YO_2$,这些都属于离子型氧化物,而且容易水解,入口即化)
过氧化物入水方程式:
$2X_2O_2+2H_2O=2XOH+O_2$
氧气通入除锂外碱金属液氨溶液或者是K 后碱金属在过量氧气中燃烧生成超氧化物($XO_2$)
臭氧和氢氧化物反应可以制取臭氧化物($XO_3$)
制取碱、碱土金属可以用熔融电解法。
例如氯化钠制取钠:
$2NaCl=2Na+Cl_2$
这个过程需要801度的高温,但是如果加入一些助熔剂,可以把温度降到700度左右。
如何炼钨?
首先需要亿块白钨矿,
见下图

白钨矿的主要成分是钨酸钙$CaWO_4$
将白钨矿与钠盐/钾盐共熔,得到$NaWO_4$
$CaWO_4+Na_2CO_3=Na_2WO_4+CaCO_3$
将钨酸钠用浓盐酸酸化,得到钨酸
$WO_4^{2+}+2H^+=H_2WO_4$
高温锻烧钨酸,得到氧化钨(VI)
$H_2WO_4=WO_3+H_2O$
氢气还原三氧化钨得到钨
$3H_2+WO_3=W+3H_2O$
如何炼铜?
这好像似乎也许不是一个问题吧
不过还是得说一说
首先,常见的铜矿有辉铜矿、红铜矿(也叫做赤铜矿,我喜欢叫他赤石)、碱式碳酸铜(孔雀石)
首先干一下辉铜矿
辉铜矿化学成分$Cu_{1.96}S$俗称硫化亚铜,提纯后高温直接生成铜
$Cu_2S+O_2=2Cu+SO_2$
但是其实发生了两个反应:
$2Cu_2S+3O_2=2Cu_2O+2SO_2$
$2Cu_2O+Cu_2S=6Cu+SO_2$
总的来看就是上面👆的化学式了
如果出现了杂质,不要慌,直接放入硫酸铜稀硫酸混合液电解!!!!
在阴极,我们就可以看到9995的Cu 了
接下来是我最爱的赤石(bushi
直接用木炭还原就好,后面要提纯的话接着电解
$2Cu_2O+C=CO_2+4Cu$
最后一个是最好看的也是最好吃的孔雀石
孔雀石的成分是$Cu_2(OH)_2CO_3$,当然也可以写成$Cu(OH)_2.CuCO_3$
加热方程式
$Cu_2(OH)_2CO_3=2CuO+H_2O+CO_2$
氧化铜直接还原
$2Cu_O+C=CO_2+2Cu$
再接着电解精制就可以了
如果需要9997到9999纯度的Cu,可以先把精制铜氧化丢进硫酸,再加热还原或电解再精制
家用或电路导线用铜纯度95到99够了
银(Ag)
一说到银,大家可能会想到银制品,银首饰,或者是银筷子验砷?
现在,我们就从这种稳定的、银白色的金属入手
银分子量108,电子排布$[Kr]4d^{10}5s^1$,这意味着银通常显示0或+1价态
实际上,银的氧化态除了这两种,还有+2,+3
银的密度为10.5倍水的密度
莫氏硬度比铜的3低,大约是2.7
Ag的导热性在周期表中排行前列,导电性在周期表中排第一
熔点961摄氏度,沸点2212摄氏度,较高。银也是重金属之一
银常常被丢到金里面做假金(但通常是钨
银微溶于水,溶于水的银可以消毒,且该浓度对人体无害
银的标准电势为0.8V,比许多元素稍高
首先先从银与硝`酸反应入手?
$Ag+2HNO_3(浓)=AgNO_3+NO_2+H_2O$
$3Ag+4HNO_3(稀)=3AgNO_3+NO+2H_2O$
这个反应只需要常温常压下进行,生成的硝酸银是易溶盐。
银的易溶盐还有AgF。
工业上制取AgCl的方法通常有两种:
1 沉淀法
$Ag^++T^-=AgT$(T 为Cl,Br,I,At)
2 亏本法
$2Ag+Cl_2⇄2AgCl$
方法一常温下进行,方法二高温下进行
因为AgF 是易溶盐,所以制取AgF 的方式是
$Ag_2O+2HF=2AgF(aq)+H_2O$
氯化银白色,溴化银显示极浅的淡黄色,碘化银淡黄色到深黄色,这三种盐溶解度依次减小
氢氧化银(AgOH)是因的唯一一种碱,可以以下方法制得:
$Ag^++OH^-=AgOH↓$
氢氧化银是白色难容物,-37摄氏度时分解:
$2AgOH=Ag_2O+H_2O$
氢氧化银溶解在氨水里生成氢氧化二氨合银
$Ag_2O+4NH_3+H_2O=2[Ag(NH_3)_2]OH
氢氧化二氨合银可以稳定存在,与热的乙醛发生银镜反应
有一个冷门的方程式了解一下:
$Cu(NO_3)_2+Ag_2O+H_2O=2AgNO_3+Cu(OH)_2↓$
硝酸银分解方程式:
$2AgNO_3=2Ag+2NO_2+O_2$
反应温度444摄氏度
其他银盐(99%难溶或微溶)性质:
浅黄色$Ag_2CO_3$,深黄色$Ag_3PO_4$,浅黄色$Ag_4Fe(CN)_6$,桔黄色$Ag_3Fe(CN)_6$
注意:含有二氨合银的物质不要久置,因为会形成$bao$诈性的$Ag_2NH,AgNH_2$