化学 一个化学问题
一个小问题,来自710第五讲🤔
就是说我和老师用的方法不同,然后结果相差的不大也不小,不知道自己做的有没有问题,请各位佬帮忙点评一下(mol
问题是eg2
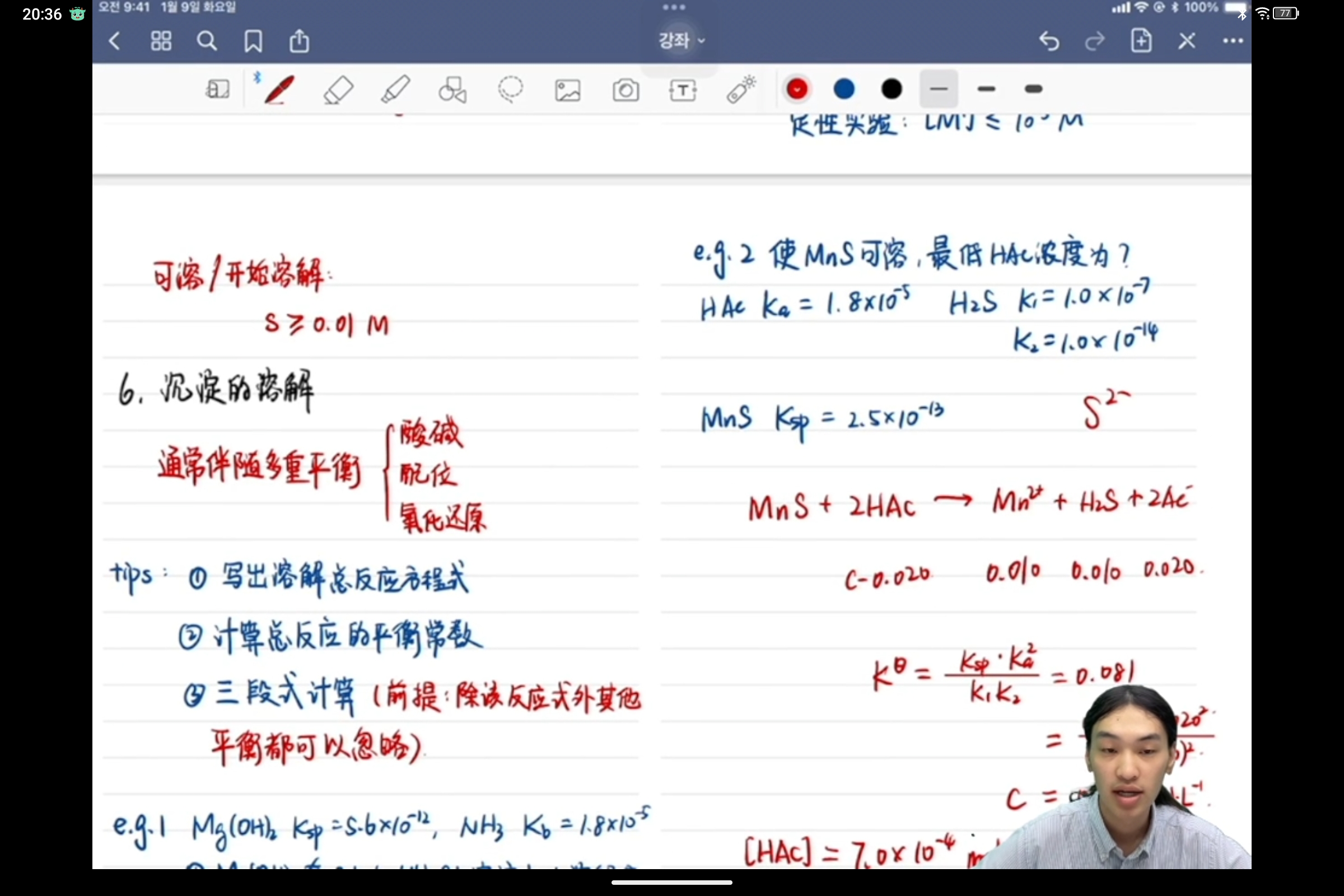

我的草稿中有两处标记,因为有效数字问题使结果误差有点大,于是我特意标多几位,以证明我的除数c-0.019不等于0~
本来我看差别不大觉得可能是误差,结果一看老师的醋酸是c-0.020,这代入我的0.0191就成负数了😳
而且老师的数0.020是精确数,便不存在四舍五入的问题😓
可我感觉我的思路和计算也没大问题诶🙃
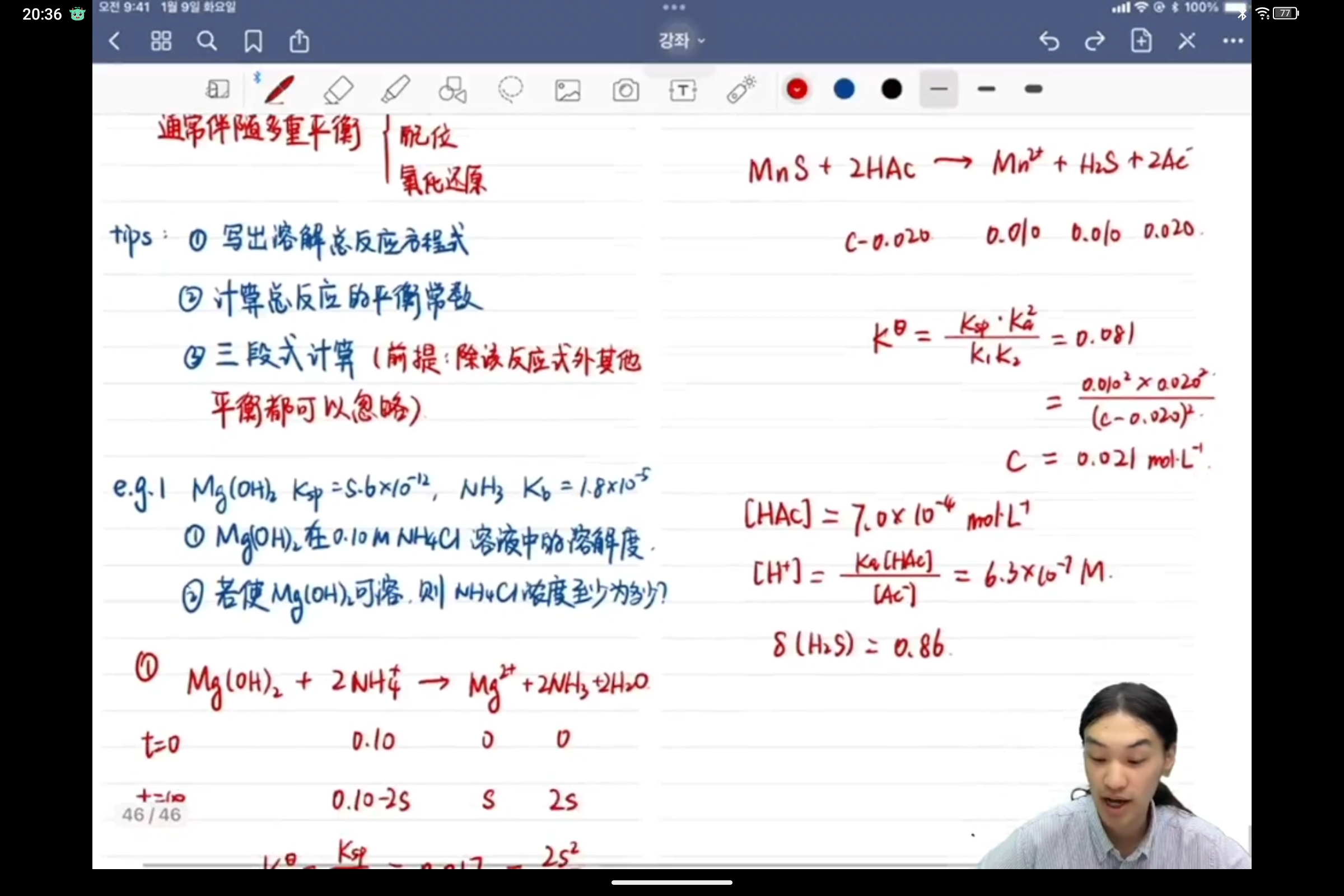
老师的结果精确来说应是0.0207,关于我和老师结果误差接近10%这件事,我有一点想法
首先老师这里的H2S标的平衡浓度是0.010,在K中也是按[H2S]=0.010算得,然而其实H2S的S是从MnS中来,也就是说0.010是指的分析浓度而非平衡浓度,包括老师最后计算H2S分不分数可能也是验证这个吧(好像把自己说明白了,笑死
其次,其实我觉得像我这种方法包括老师的方法好像都忽略了一点,就是说醋酸的电离和硫化氢的形成是同时进行的,也就是说比如我先让0.1mol醋酸电离出0.001mol的醋酸根和氢离子,然后S离子把这H离子都消耗了,此时没氢离子了看起来似乎要再加0.1mol醋酸来新电离出0.001mol H离子,然而事实上是由于H离子浓度下降,平衡右移,不需要再加酸,原本的0.1mol醋酸就能电离出新的H离子,而我的方法是一缺H离子就添酸,所以我的结果似乎比精确值也要稍大点🙃
考试的时候按近似写就行了,不过我还是好奇精确的该怎么算,不知哪位大佬能传授一下😅
(BTW吐槽一下,还是觉得老师误差有点大,毕竟H2S分布分数都只有0.86😅
另外,老师说还有第二种方法,就是按S离子算,似乎跟我的方法差不多,但老师不讲说发群里,本人新生一无所知,不知道哪位好心人能拍一下3Q🙏
马上国初,大家一起加油👊👊


