共6条回复
时间正序
- 时间正序
- 时间倒序
- 评论最多
LHMDS(御用强碱)
1年前
2024-7-17 10:15:04
如你所见,本文报道了一种不使用金属催化来对C-H bond进行活化并官能团化的一种方法,可以看到,此反应经历了自由基历程,接下来我们将对这篇文献进行解读
LHMDS(御用强碱)
1年前
2024-7-17 10:32:06
文献解读:
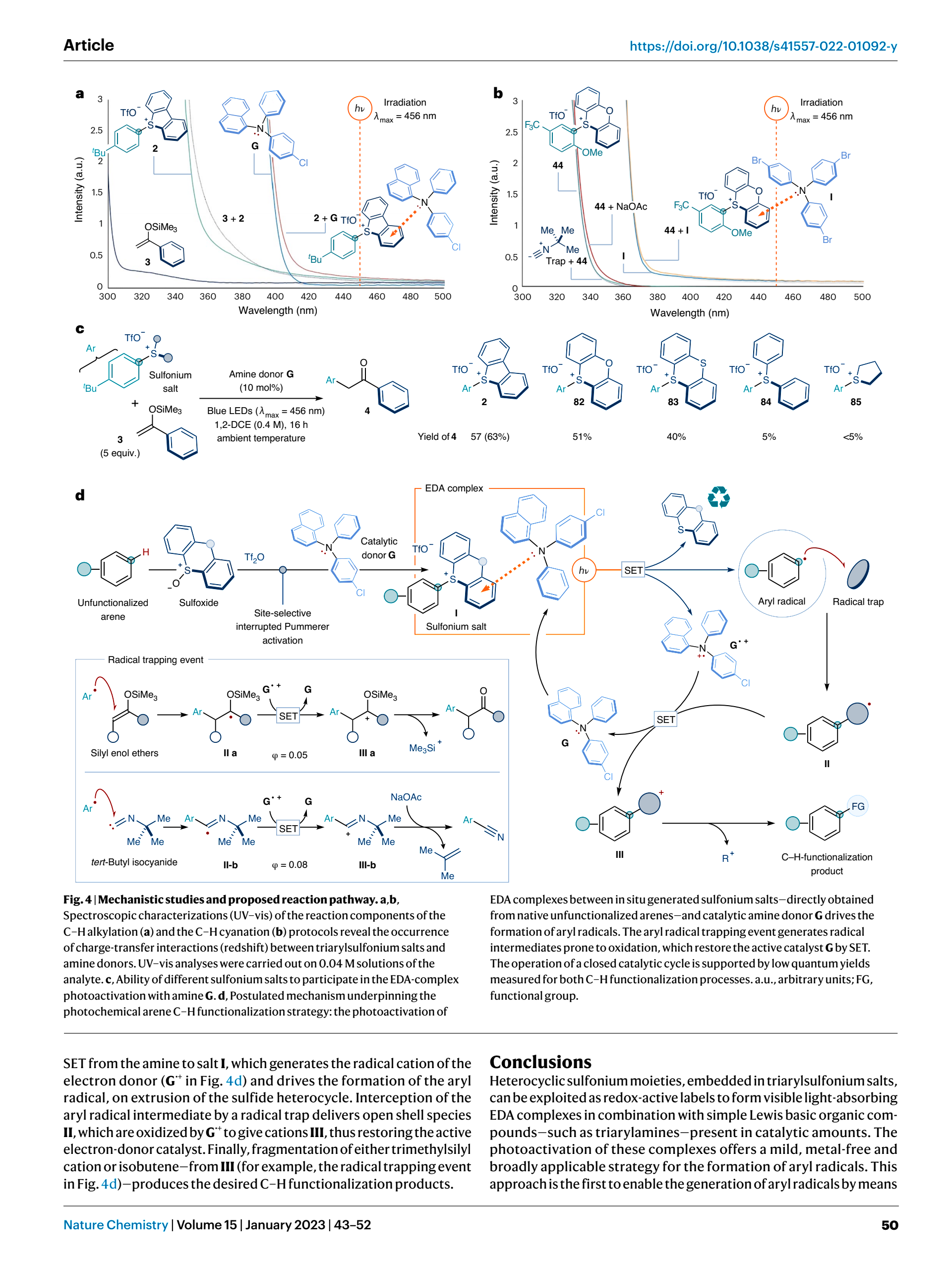
首先,让我们对机理进行分析,请注意观察,反应中使用到了一种硫杂氧杂的芳香稠环,让我们从这里入手
没错,就是这个

如果你曾经做过GChO的试题,抑或是常常涉猎各类文献,你就会发现,如上的这种催化剂,十分常见!
如果我们将如上的电荷分离式改回原本的结构式,你就得到一个亚砜,就像我们所熟知的那样,硫氧间的π*能量较低,因而十分容易填充电子,也就造就了如上硫亲电,氧亲核的双重性质
LHMDS(御用强碱)
1年前
2024-7-17 10:44:09
让我们来观察这一部分
显然,这部分给出了反应的作用机制
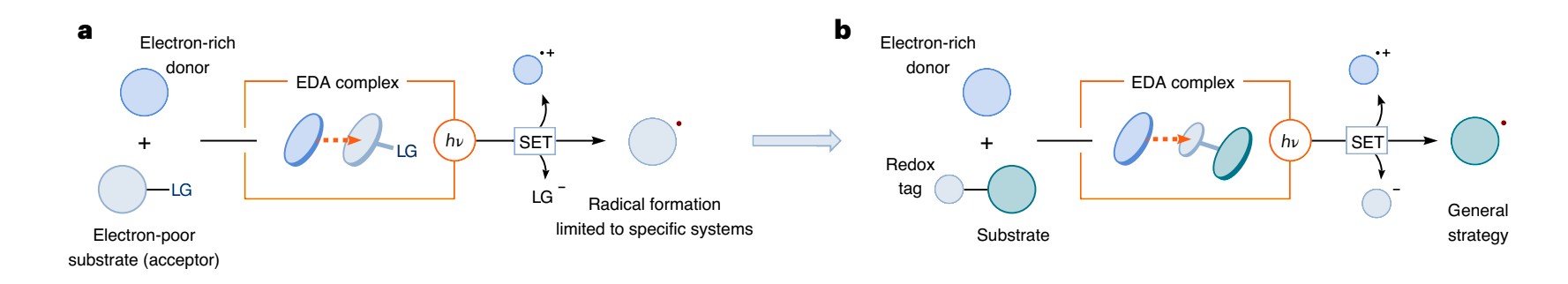
对(a)过程,可以看到,反应由富电子的电子给体及缺电子的受体,形成donor-acceptor的结合,再在光照下脱去Left Group与给出Eletron-donor,形成了具有较高反应活性的自由基,完成了对惰性C-H bond的转化,使其易于反应
而对(b)过程则是将原本的Eletron-acceptor变为了氧化还原剂,并且同时充当Left Group的角色,达到与(a)过程等同的效果
LHMDS(御用强碱)
1年前
2024-7-17 10:52:52
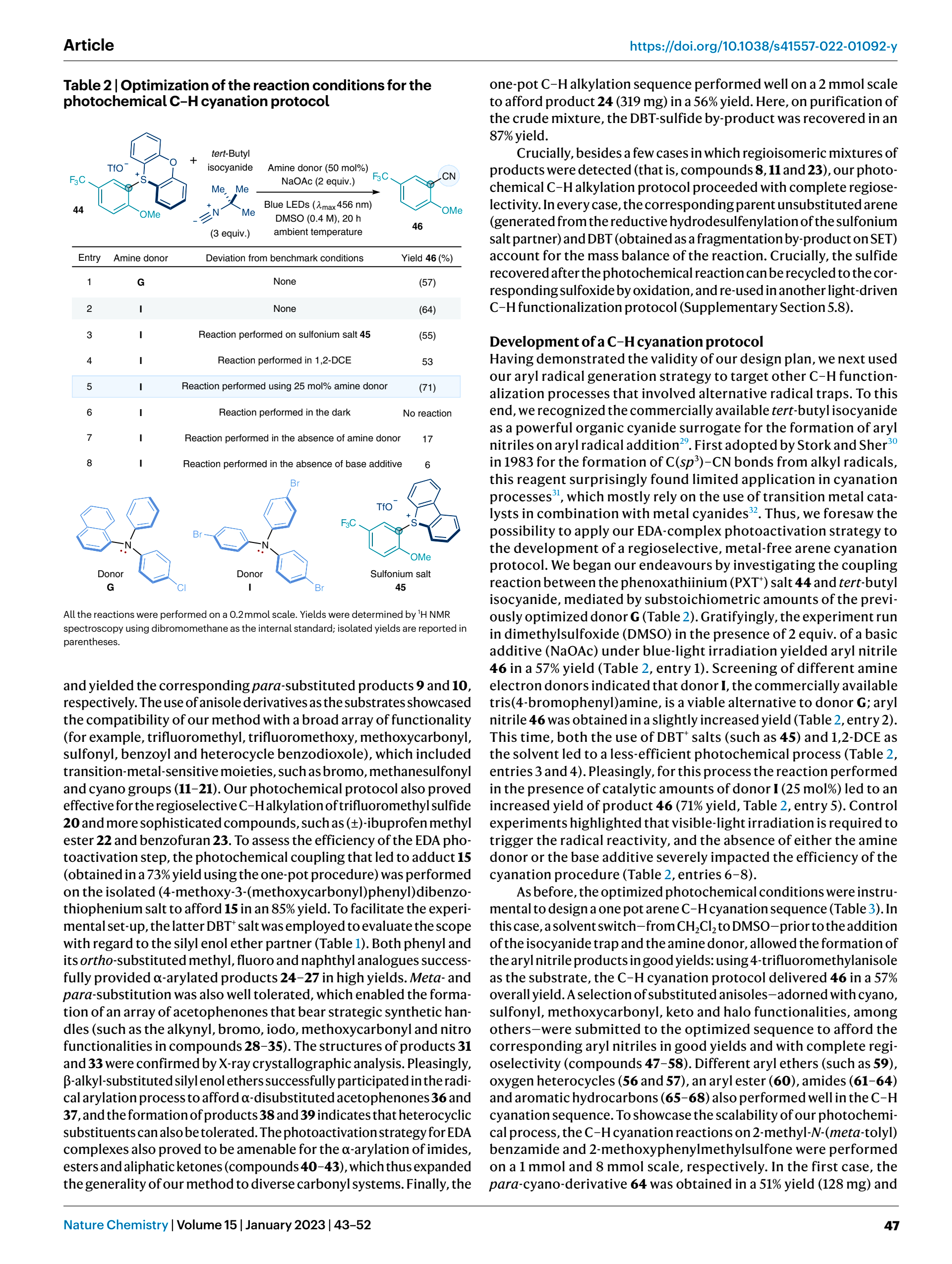
接下来再回到刚才提及的那个亚砜(接下来我们称之为亚砜A),将目光移至(c)与(d)过程
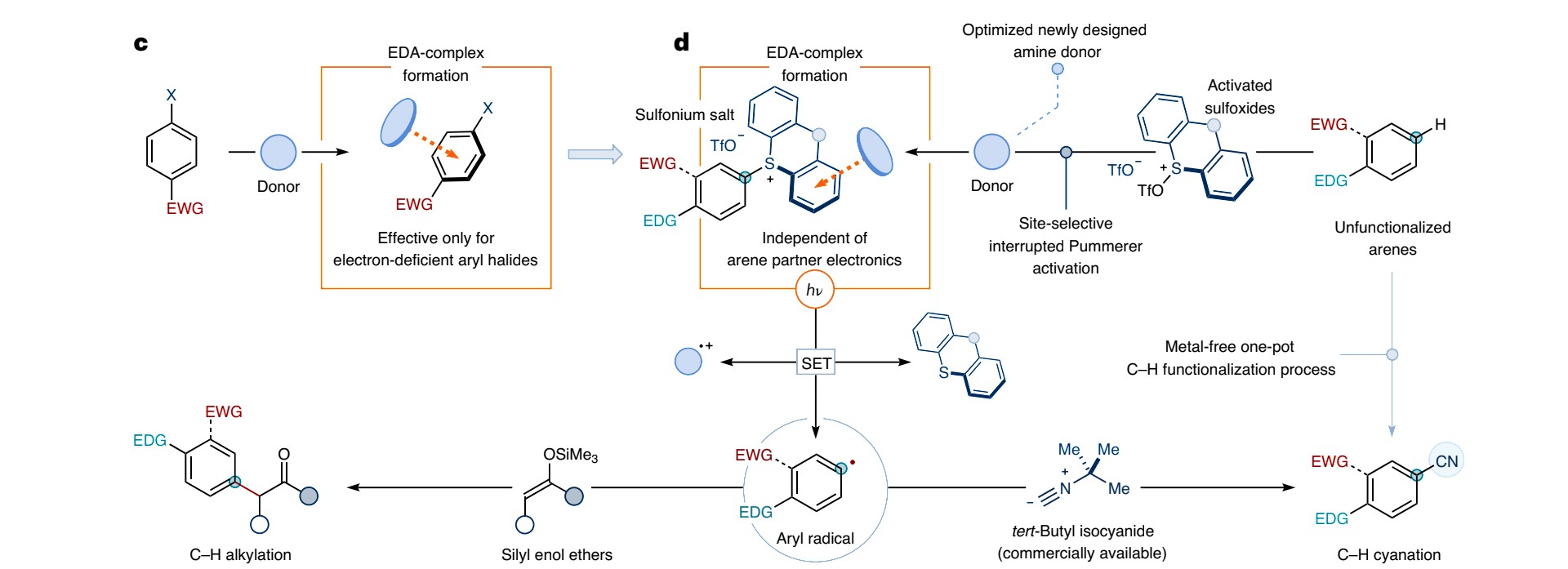 我们可以很容易的看出,上述的物质是由亚砜A与三氟甲酸酐作用得到的,并且在反应中充当了Left Group的角色,接下来在生成芳香自由基后的步骤就不难理解了
我们可以很容易的看出,上述的物质是由亚砜A与三氟甲酸酐作用得到的,并且在反应中充当了Left Group的角色,接下来在生成芳香自由基后的步骤就不难理解了
1条评论 评论
- 1
LHMDS(御用强碱)
1年前
2024-7-19 10:07:59
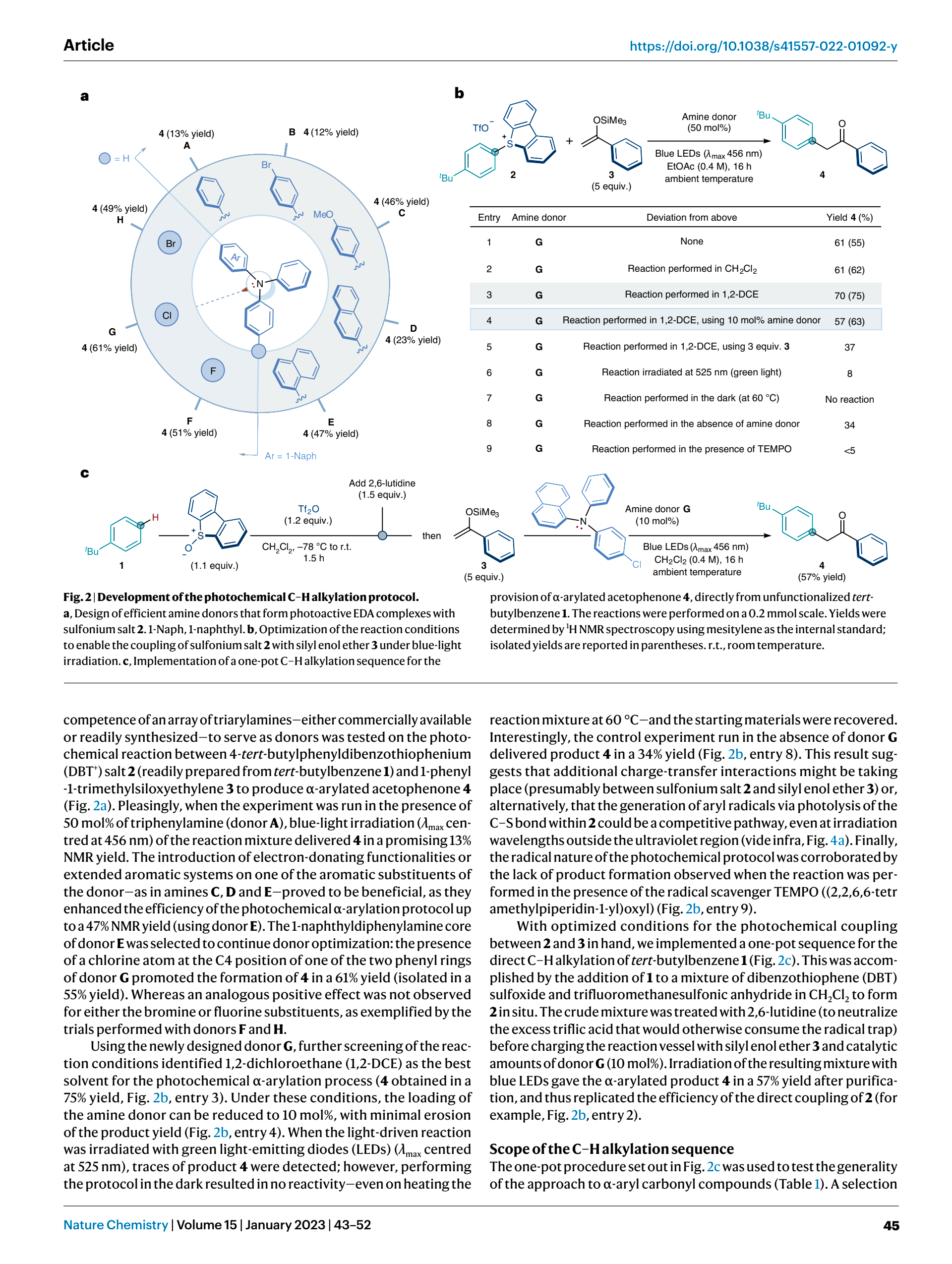
书接上回,让我们来看看对Eletron-donor所接基团及反应条件的改变会对反应造成哪些影响
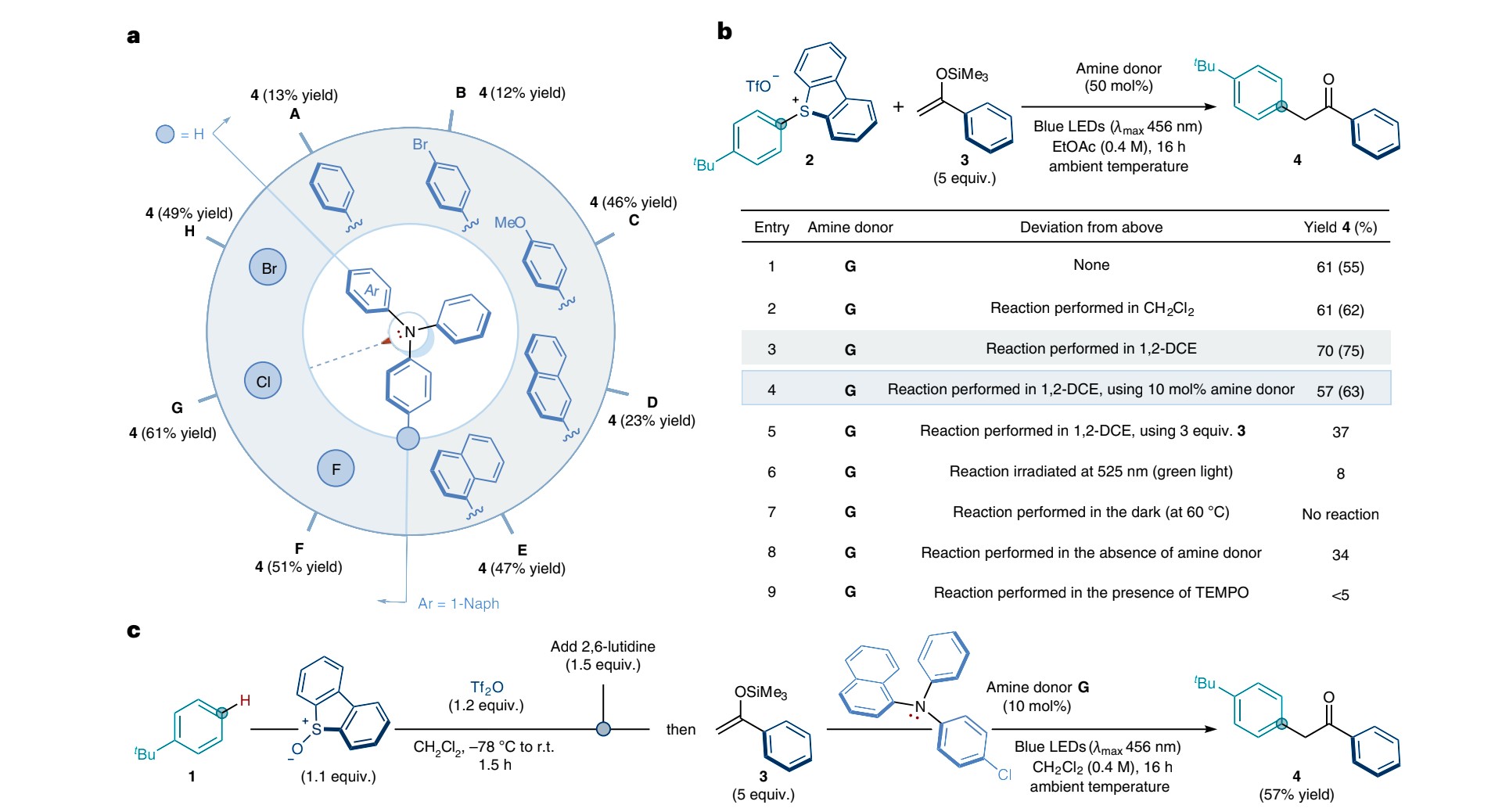 不来看出,这里采用了另一种亚砜,我们暂且称之为亚砜B,从结构上来看,其仅仅将亚砜A的氧杂硫杂六元环改为了硫杂五元环,这里影响不大故暂不予考虑
不来看出,这里采用了另一种亚砜,我们暂且称之为亚砜B,从结构上来看,其仅仅将亚砜A的氧杂硫杂六元环改为了硫杂五元环,这里影响不大故暂不予考虑
让我们在再来看看对Eletron-donor结构的改变会对产率造成何样的影响?