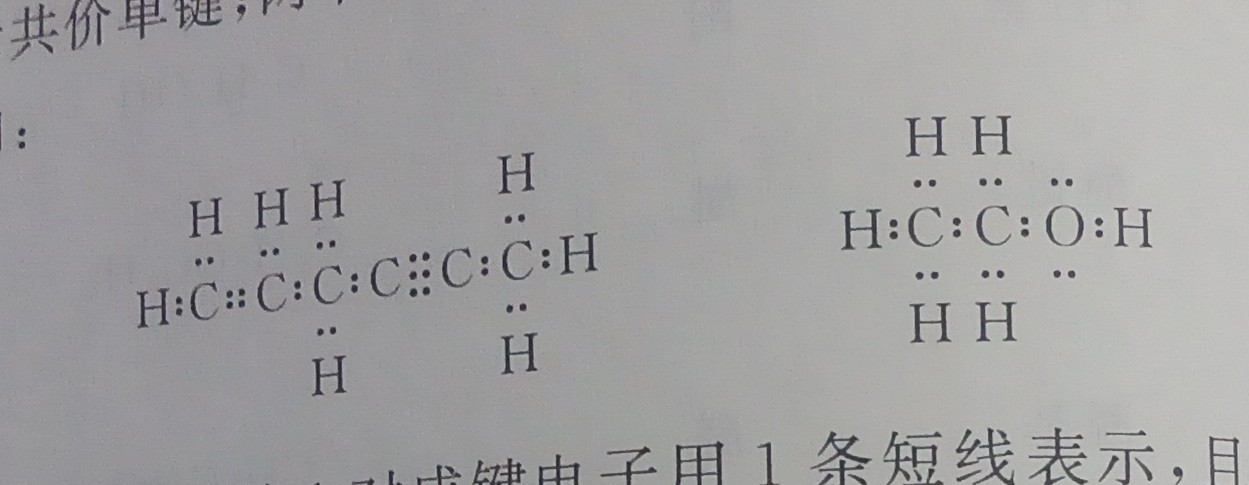物理 有机化学 第一章绪论(没啥水分,都是干的)
(突然良心发现想填坑了🙃🙃🙃
逝图挽救
-----------------------------------分隔线--------------------------------------------------------------------------------------------------------------
日志:
2024,7,28 诱导效应,共轭效应
2024,7,24-27 无
2024,7,23 无
2024,7,22 无
2024,7,21 诱导效应
2024,7,20 无
2024,7,19无,今天也先鸽着吧
2024,7,18 无或是说只有一点点有关氢键的东西
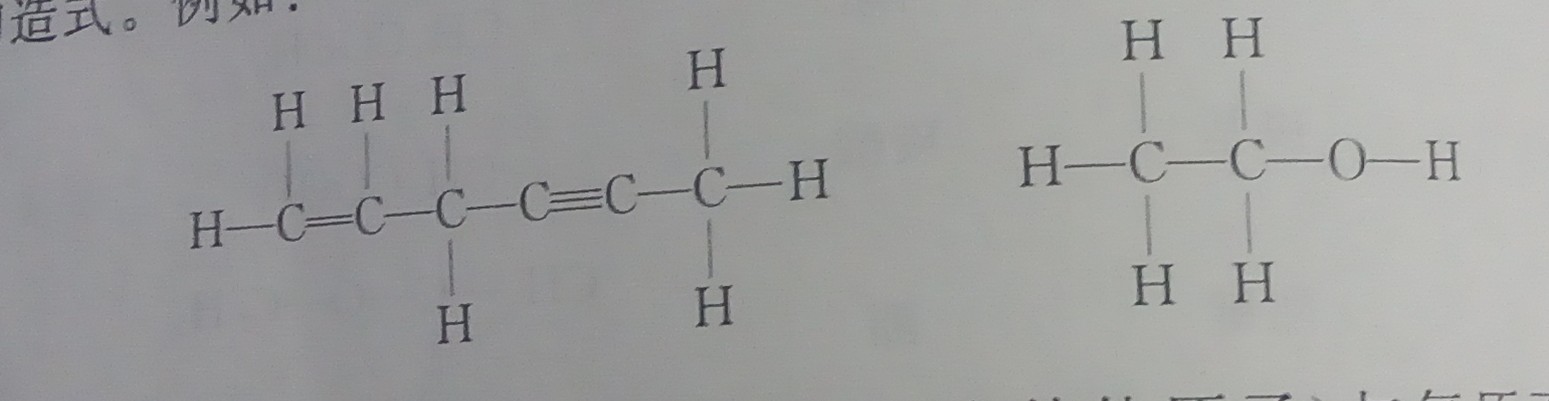
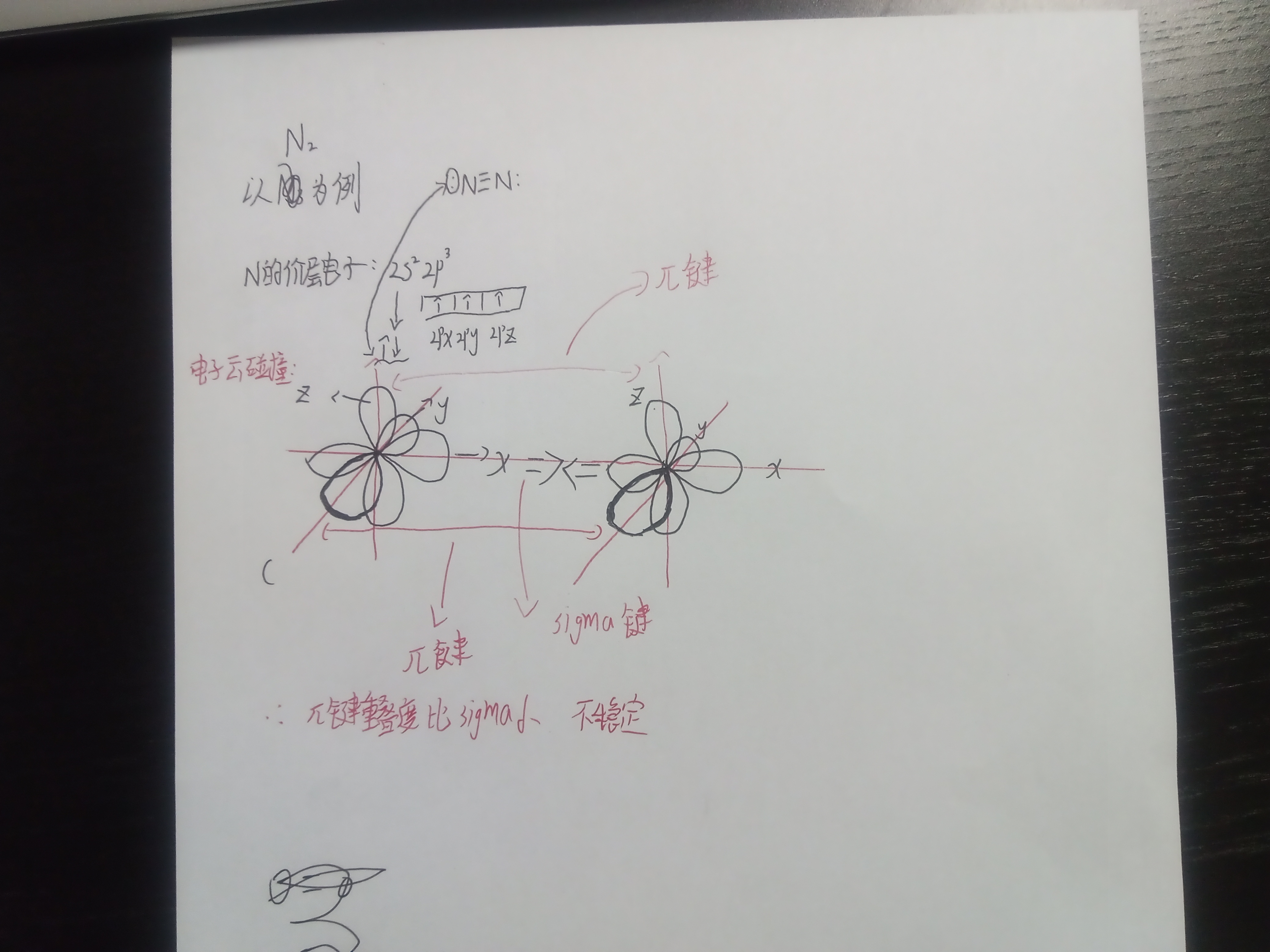
2024,7,17 有机化合物构造式表示方法,派键(某人提议)(关于我把N2写成N3导致我重新写了一遍这件事)
2024,7,16 有机化合物的特点,共价键参数及分类方法
-----------------------------------------------------------------
你作为一名数物竞赛生,有一天下午,你在去学数物的路上,发现了一本《有机化学》,你捡起,并看了起来......
咳咳,好了
第一节,有机化合物
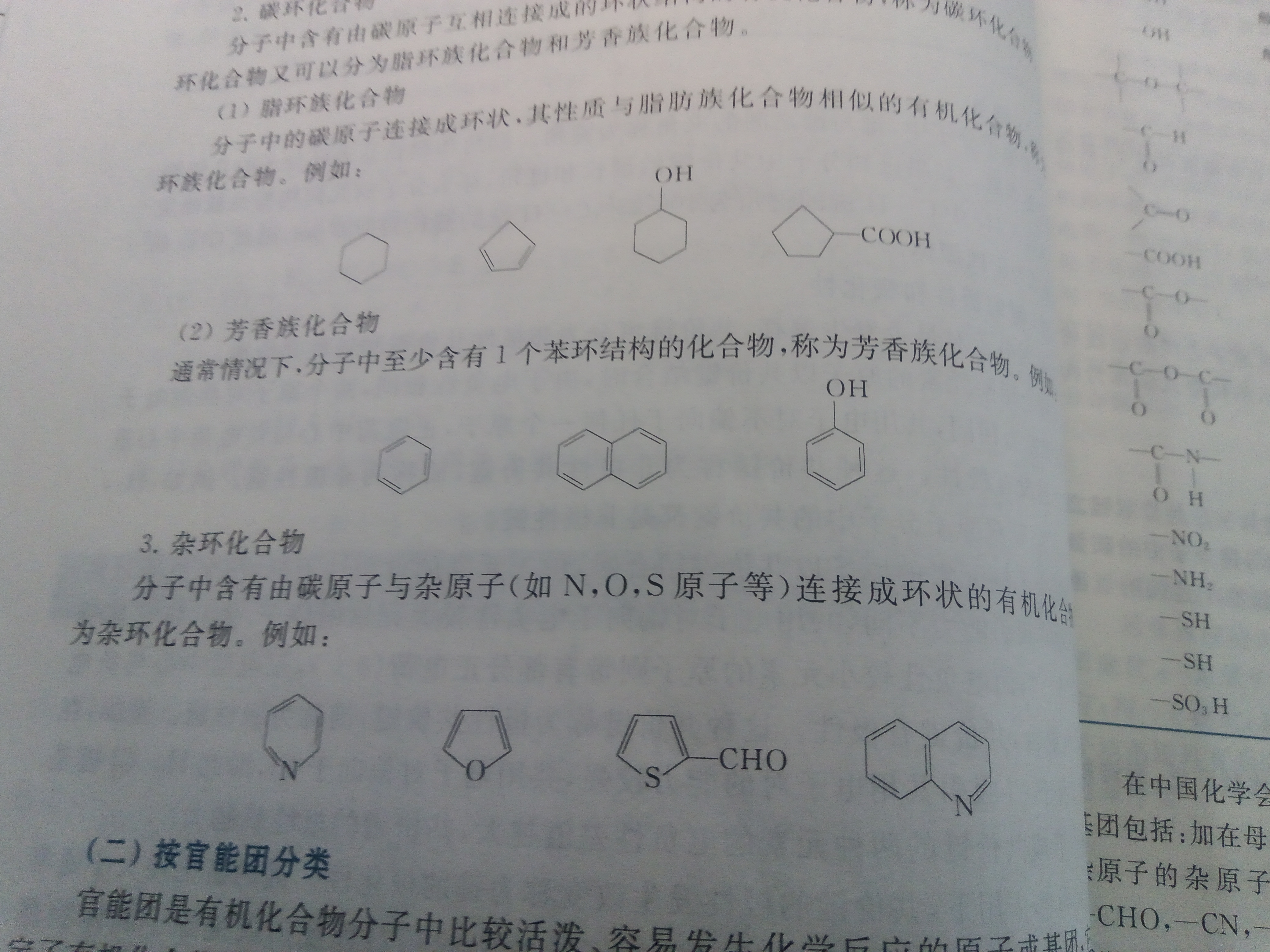
有机化学顾名思义就是研究有机化合物的组成,结构,性质,及其变化。所以我们就要先了解有机化合物,众所周知在我们身边的自然中有一亿多种物质,化学上,我们可以简单将它们分为无机物和有机物,无机物指的就是除碳以外,有其他元素形成的单质和化合物(由于我们讲的是有机物,就不多赘述)(但要注意的是:我们通常把一氧化碳,二氧化碳,碳酸盐及金属氰化物等一些含碳化合物也看作是无机物)那自然而然,有机物就是指含碳的化合物,绝大多数还含有氢,一部分还含有氧,氮,溴,碘,硫和磷等元素。
Tips:如果我们将碳氢化合物看作是有机化合物的母体,并将其中的氢原子被其他原子或者基因取代而生成的化合物看作其衍生物,应此,我们也将有机化合物定义为碳氢化合物和其衍生物
一,有机化合物的特点
有机化合物原子间的化学键是典型的共价键,分子间的相互作用力则是范德华力(较弱),所以有机化合物有如下几个特点
1,热稳定性较差,容易燃烧,受热易分解
2,熔点和沸点较低
3,大部分难溶于水,但却易溶于非极性和弱极性的有机溶液中
反应速率慢,一般要在加热光照和催化下才会发生反应,且主反应会带有副反应,而副反应产物一般是好几种产物的混合物
二,共价键参数
有机化合物的化学键是共价键,这也是其基本的结构特征。常见有键能,键长,键角,键的极性和极化性,下面我们就来一一讲解
1,键能
首先我们需要知道解离能,比如说将一个气态分子(A-B)解离为气态原子A和气态原子B 的能量,就成为A-B 键的解离能,用Ed(A-B)表示。现在,我们就可以了解键能了:
对于双原子分子,键能就等于键解离能,用Eb表示
比如说:H2(g)==2H(g) Eb(H-H)=Ed(H-H)=436kJ •mol-1
而对于多原子分子,键能就等于键解离能的平均值,
比如说:CH 4就有4个等同的C-H,但每个的建解离能是不同的,应此就去4个键的解离能的平均值 Eb (C-H)=414.5kJ•mol-1
我们知道了键能,就可以用键能来衡量共价键的牢固程度,键能越大,就越牢固
2,键长
键长是分子中两个成熟键原子的核间平衡距离,记为l
例如:H2的两个H核间平衡距离是74pm,所以(H-H)键的键长就是74pm
下面给大家一些常见有机化合物的键长(l/pm)和键能(Ed/(KJ•mol-1)
键长 键能
C-H 109 415
C-C 154 347
C-N 147 305
C-O 143 360
C-S 272
C-F 141 485
C-C1 176 339
C-Br 194 285
C-I 214 218
C==C 134 611
C==O 122 736
C==N 749
C≡≡C 120 837
C≡≡N 116 880
3,键角
一般来说,在多原子分子中,键和键之间的夹角就是键角,这个键角和上面的键长是表征分子几何构型的十分重要的参数,知道了键长和键角,就可以说是知道了分子的几何构型
例如:CH4的C-H键的键角为109度28分,键长是109pm,由此我们就可知CH4为正四面体
4,键的极性和极性化
我们知道根据公用原电子是否发生偏移,我们将共价键分为非极性和极性
那么当两相同元素的原子结合是时,因其电负性相同,两原子对公用电子的吸引力相同,公用电子不偏向任何一方,所以正电荷与负电荷中心重合,则没有极性,就是非极性共价键(H2 ,N2,O2,CI1等)
反之,不同元素原子结合时,电负性不同,吸引力也不同,则公用电子偏向电负性较大的,并使其带有一部分负电荷(δ-),而吸引力较小的,则带有部分(δ-)正电荷,正负电荷中心不重合,有极性,为极性共价键。(例如:H-C1,C1吸引力更强,公用电子偏向C1,so H-C1为极性键)
两种元素的电负差越大,极性就越大
但如果收到外力影响,在外电场下,极性改变就是键的极性化,其大小用极性度表示,可用以代表成键原子被成键原子核约束的相对程度,成键原子越大,电负性越小,对成键原子的约束就小了,极化度越大。(例如,碳卤键的极化度就是C-I>C-Br>C-C1>C-F)
这里我们要注意,由于成键电子和原子核都在运动,所以能使共价键产生瞬间极化,so无论是极性键还是非极性键都有一定极化度![]()
(2h)